编者按:Young-PEARL和PEARL均为对比CDK4/6抑制剂联合内分泌治疗与卡培他滨单药治疗HR+/HER2-晚期乳腺癌的临床试验,却取得了截然相反的结果。但在两者的研究设计、患者基线情况等差异中,又恰好一正一反的反映了CDK4/6抑制剂在HR+/HER2-晚期乳腺癌治疗中的用药时机、人群选择等实践问题。且看本期“曼话乳癌”中,李曼教授、李娜教授如何解析Young-PEARL和PEARL研究的“画中意境”和“弦外之音”。
过去的一年对于大多数的中国患者而言是“幸运”的一年。随着哌柏西利在中国上市,我们看到许许多多因疼痛呻吟不止、寸步难行多发骨转移患者经过哌柏西利治疗能够谈笑自若、步履轻盈的回归正常生活;我们看到许许多多因胸闷气短、不能平卧多发肺转移患者经过哌柏西利治疗能够神清气爽、从容自如地面对生活,我们看到许许多多因肝区隐痛不适、恶心纳差多发肝脏转移患者经过哌柏西利治疗能够容光焕发、平复如故地笑谈人生;我们甚至看到内分泌耐药的患者经过哌柏西利治疗能够霍然而愈,由此让更多的医生对于内分泌治疗信心满满,让更多晚期乳腺癌患者看到“拨云见日”的未来。
过去的一年从HR+/HER2-晚期乳腺癌治疗领域来看是“纠结”的一年,当内分泌治疗与化疗狭路相逢的时候,我们看到Young-PEARL研究结果显示内分泌治疗较化疗能够明显延长绝经前HR+/HER2-晚期乳腺癌患者无进展生存时间(PFS)。正当人们已经接受HR+/HER2-晚期乳腺癌应该首选内分泌治疗时,今年圣安东尼奥会上PEARL研究结果显示内分泌治疗与化疗并没有改善芳香化酶抑制剂(AI)治疗失败患者的PFS,我们不仅要问内分泌治疗在HR+/HER2-晚期乳腺癌治疗领域真的患得患失?
Young-PEARL研究是第一个在绝经前HR+/HER2-晚期乳腺癌患者中进行内分泌治疗与化疗比较的前瞻性、随机、多中心、开放Ⅱ临床研究,共纳入14个中心189例患者,允许既往行一线化疗患者及一线行他莫昔芬治疗患者入组。184例患者随机分为哌柏西利+依西美坦+亮丙瑞林组(92例) 和卡培他滨组(92例) (图1)。中位随访17个月,哌柏西利联合内分泌治疗组的疗效显著优于卡培他滨,中位PFS分别为20.1个月和14.4个月(HR=0.659;95%CI:0.437-0.994;P=0.0469)(图2)。预先设定的亚组中既往未接受过化疗及无内脏转移患者,哌柏西利联合依西美坦组PFS均显著优于卡培他滨组,这提示在HR+/HER2-晚期乳腺癌一线治疗中内分泌治疗“更胜一筹”,即使在二线治疗中内分泌治疗依然“大有可为”。
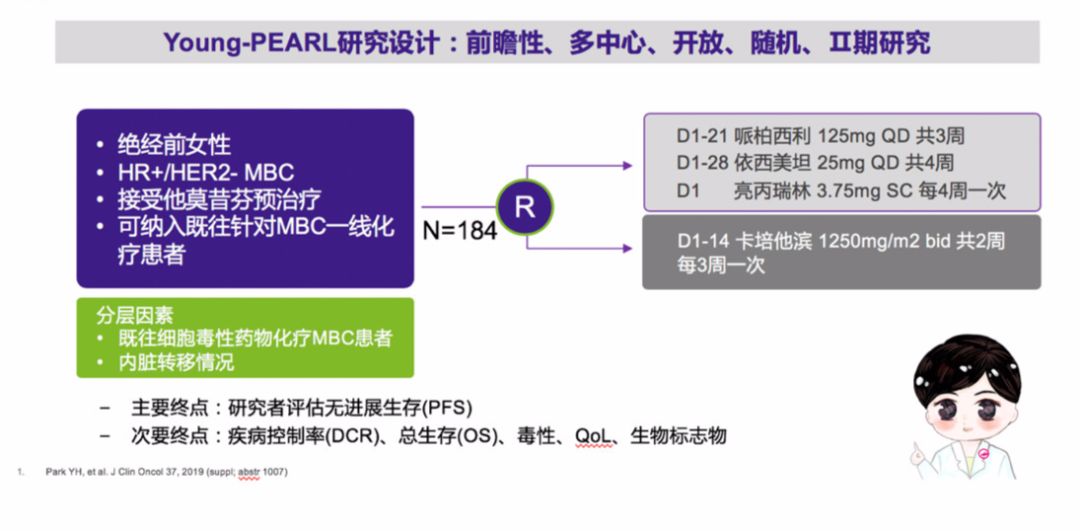
图1
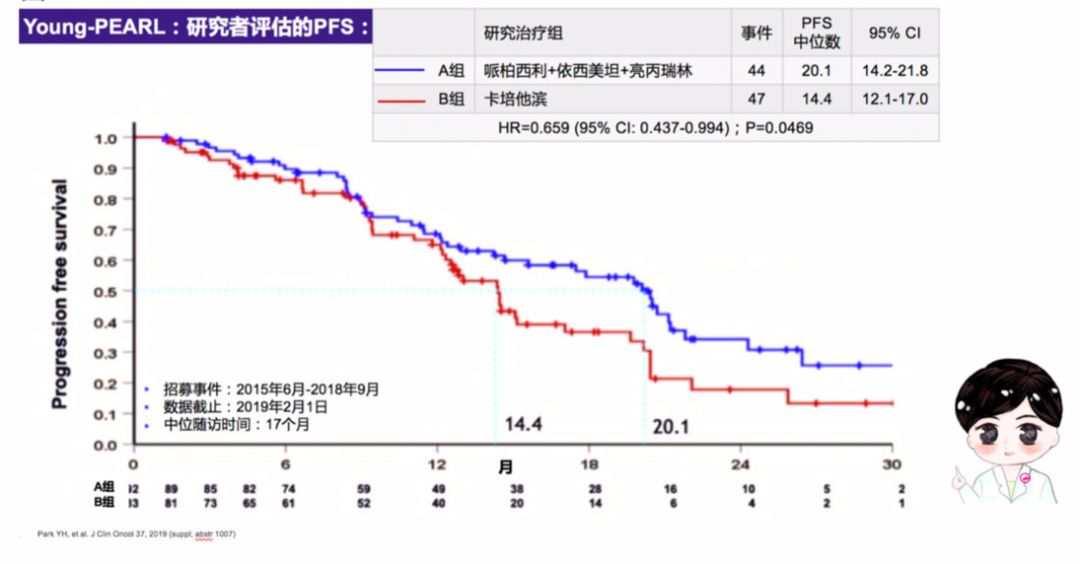
图2
PEARL研究是一项在绝经后AI治疗失败HR+/HER2-晚期乳腺癌患者中进行内分泌治疗与化疗比较的多中心、开放、随机对照的III期临床研究,共纳入37个中心601例患者,患者主要为既往接受AI治疗失败的人群,包括完成AI辅助内分泌治疗1年内复发、AI停药一个月内复发或者AI治疗中复发的人群。
本研究包含两个队列,队列1共296例患者, 为非甾体类AI治疗失败的患者,按照1:1随机分配哌柏西利+依西美坦组和卡培他滨组。2016年中期数据表明ESR1突变可诱导肿瘤细胞对AI耐药,而ESR1突变与氟维司群的敏感性无关,因此开展了队列2研究,共305例患者按照分别1:1随机分配哌柏西利+氟维司群组和卡培他滨组(图3)。本研究设定两个联合主要终点,分别是队列2 的PFS以及队列1和队列2中ESR1野生型患者的PFS。中位随访13.5个月时, 哌柏西利+氟维司群组和卡培他滨组的中位PFS分别为7.5个月和10个月(HR=1.09;95%CI:0.83-1.44,P=0.537)。中位随访18.89个月,队列1和队列2中ESR1?野生型亚组分析显示,哌柏西利+ET组和卡培他滨组的中位PFS分别为8.0个月和10.6个月(HR=1.08;95%CI: 0.85-1.36, P=0.526)(图4)。值得注意的是,PEARL研究为优效性设计,统计预设的HR值为0.667,令人遗憾的是此研究中,哌柏西利+内分泌治疗对比卡培他滨并没有显示出疗效上的优势。

图3
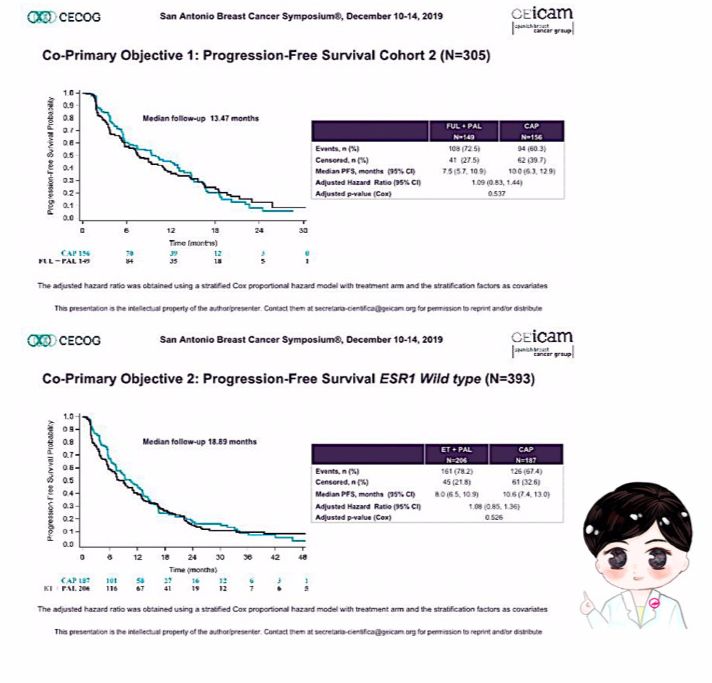
图4
当然,从安全性分析来看,哌柏西利联合内分泌组还是“略胜一筹”,两组的不良反应“大相径庭”。哌柏西利联合内分泌组的3度及以上的常见不良反应为中性粒细胞减少,严重不良事件发生率为4%左右,停药率却仅为3.7%;而卡培他滨组3度及以上的常见不良反应为手足综合症、腹泻、乏力以及贫血,严重不良事件发生率为10.4%,停药率高达12.8%。从不良反应的相对风险比来看,卡培他滨组的不良事件发生风险也要远高于哌柏西利联合内分泌组(图5)。由此可以告诉我们,当内分泌治疗与化疗疗效相当时,安全性成为我们选择治疗的“重中之重”。
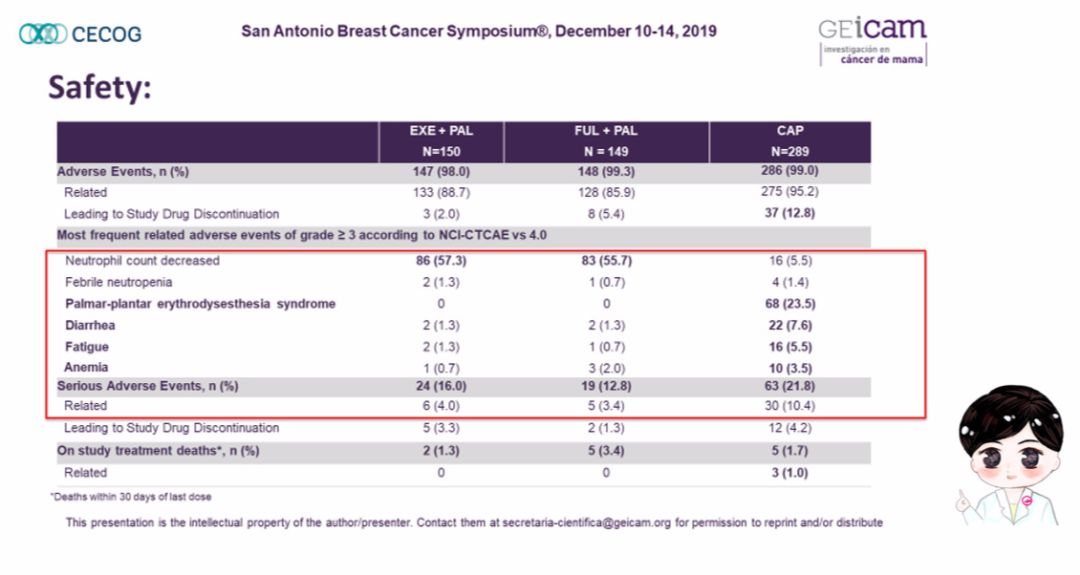
图5
Young-PEARL和PEARL两个相似的临床研究均为CDK4/6抑制剂联合内分泌治疗与卡培他滨单药治疗HR+HER2-晚期乳腺癌的疗效对比,却取得了截然相反的结果,令人茫然不解。究其原因,可能与两个临床研究入组人群特征有关。Young-PEARL研究入组晚期一线治疗患者占(50%)晚期二线治疗患者占(33%),未接受任何化疗患者近80%,94%患者仅接受过他莫昔芬的内分泌治疗且所有患者未使用过AI,因此均为AI相对敏感人群,所以内分泌治疗获益更大。而PEARL研究中入组晚期一线治疗患者仅占(17.6%)晚期二线治疗患者占(41.2%),晚期三线及以上治疗患者占(41.2%), 80%以上患者为多线治疗患者,且所有入组患者均接受过一线及以上内分泌治疗,AI耐药患者(包括原发以及继发内分泌耐药)占70%,氟维司群耐药患者占28.8%,并且从大会报导的最终结果来看,10%的入组患者为非Luminal型(图5),因此这类患者对内分泌治疗的反应性明显下降,是导致该临床试验阴性结果的主要原因。由此可以告诉我们以CDK4/6为主的联合内分泌治疗更适合内分泌敏感人群且一线治疗获益更大,因此两个相同试验药物的临床研究因为入组人群存在“云泥之别”、治疗时机选择“截然不同”出现“南辕北辙”的结果。当然,PEARL研究的失利也需要警醒我们,CDK4/6抑制剂并不是万能的神药,多线治疗后患者的药物选择仍然需要继续探索。
过去的一年对于HR+/HER2-晚期乳腺癌患者来说是“幸福”的一年,在Young-PEARL研究数据证实CDK4/6抑制剂联合内分泌治疗优于化疗基础上,PALOMA-3、MONARCH-2和MONALEESA-3研究均提示对于绝经后HR+/HER2-晚期乳腺癌患者,CDK4/6抑制剂联合内分泌治疗不仅取得PFS获益,也明显改善总生存时间,由此夯实不同CDK4/6抑制剂联合内分泌治疗在HR+/HER2-晚期乳腺癌一线、二线治疗中“举足轻重”地位。Young-PEARL与PEARL两颗“珍珠”交相辉映,为HR+/HER2-晚期乳腺癌的全程管理迎来曙光,点亮了我们对CDK4/6抑制剂的合理认知。
参考文献:
1. Slamon DJ, Neven P, Chia S, et al. Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3.J Clin Oncol. 2018;36(24):2465–2472.
2. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: Abemaciclib in Combination With Fulvestrant in Women With HR+/HER2- Advanced Breast Cancer Who Had Progressed While Receiving Endocrine Therapy.J Clin Oncol. 2017;35(25):2875–2884.
3. Park YH, Kim TY, Kim GM, et al. Palbociclib plus exemestane with gonadotropin-releasing hormone agonist versus capecitabine in premenopausal women with hormone receptor-positive, HER2-negative metastatic breast cancer (KCSG-BR15-10): a multicentre, open-label, randomised, phase 2 trial.Lancet Oncol. 2019;20(12):1750–1759.
硕士,副教授,毕业于大连医科大学,自2008年开始在大连医科大学附属第二医院肿瘤内科工作。2016年至2018年赴美国哈佛大学附属Dana-Farber Cancer Institute做高级访问学者。目前主要从事乳腺癌临床诊治工作,主要的研究方向为乳腺癌靶向治疗及靶向药物耐药机制。现任中国医药教育协会乳腺疾病专业委员会乳腺癌多学科诊疗学组委员,主持国家自然科学基金青年基金项目1项,参与国家级及省级自然科学基金多项,以第一作者在国内外期刊发表论文多篇,单篇最高影响因子10.199。





 京公网安备 11010502033352号
京公网安备 11010502033352号