过去一年中,国内外乳腺癌治疗领域多项研究取得重大突破,从而改变了指南,更好的指导了临床实践。日前,在河北医科大学第四医院耿翠芝教授主持下,广东省中医院陈前军教授、中国科学技术大学附属第一医院潘跃银教授、辽宁省肿瘤医院孙涛教授共同做客“为她而战”直播间,就2019年乳腺癌国内外指南的更新要点进行解读。
对于早期绝经前HR+乳腺癌患者,SOFT研究将符合入组条件的3047例患者随机分成三组,分别接受他莫西芬、他莫西芬+卵巢功能抑制(OFS)、依西美坦+OFS,主要研究终点为DFS。8年随访结果显示,接受他莫昔芬+OFS和单纯他莫昔芬治疗的患者,8年DFS分别为83.2%和78.9%,DFS绝对获益4.3%;接受依西美坦+OFS治疗的患者中,DFS为85.9%,相比于单纯他莫昔芬治疗,8年DFS率的绝对差值为7.0%。依西美坦+OFS较他莫西芬+OFS进一步改善了患者的无病生存,降低23%的复发风险。TEXT & SOFT研究中位随访9年结果也显示了依西美坦+OFS获益的趋势。
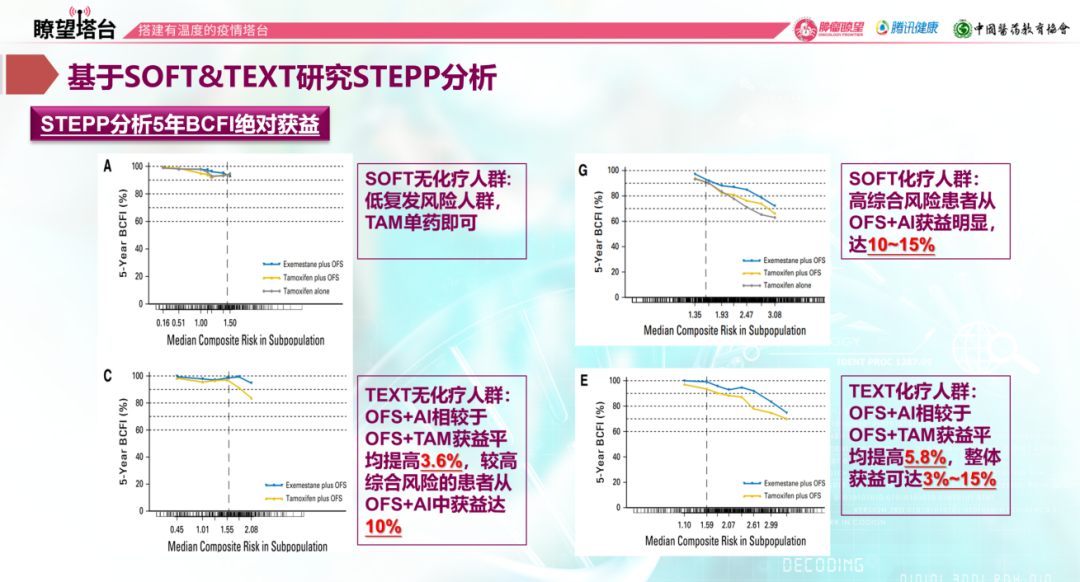
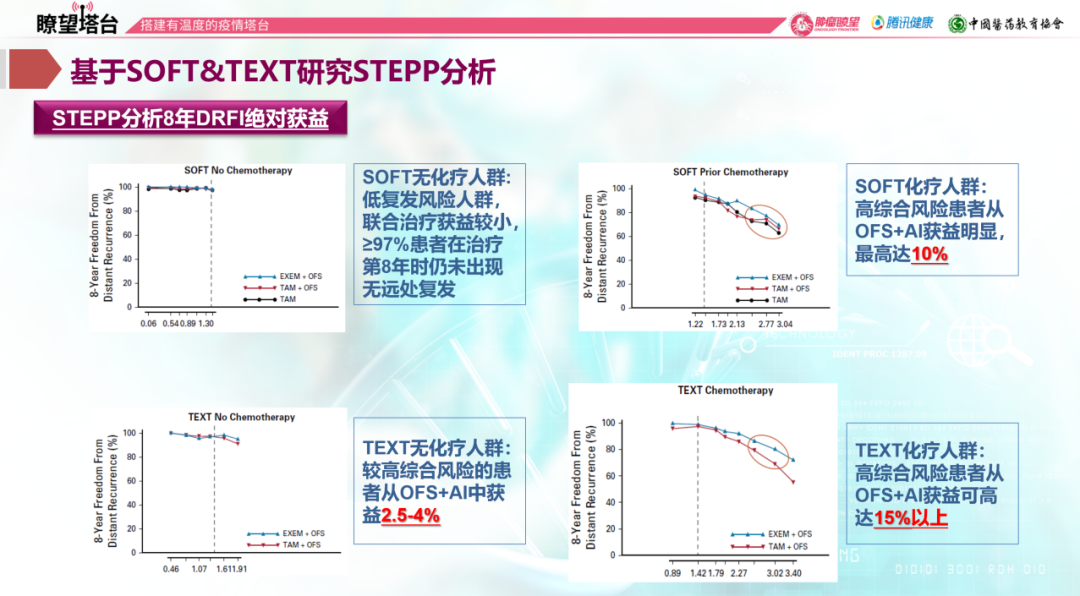
基于TEXT & SOFT研究,一种新的分析方法—STEPP(subpopulation treatment effect pattern plot)出现,该分析方法将患者年龄、淋巴结、肿瘤大小、分期、ER、PgR和Ki-67纳入Cox比例风险模型进行量化评估。结果显示在无乳腺癌间期(BCFI)获益方面,无化疗人群中,SOFT研究STEPP评分基本<1.59,使用他莫西芬即可;TEXT研究<1.59人群与SOFT无化疗人群相似,建议使用他莫西芬足够。而>1.59的人群,使用AI+OFS优于他莫西芬+OFS。对于化疗人群,TEXT&SOFT研究均显示了AI+OFS的获益,TEXT研究中,AI+OFS较他莫西芬+OFS获益平均提高5.8%。在无远处复发间期(DRFI)获益方面,无化疗人群中,低复发风险人群联合治疗获益较小,高风险人群从AI+OFS获益更明显;化疗人群中,高风险人群从AI+OFS获益高达10%~15%。
自2016年v2-2020年v3版的NCCN指南在诊疗路径中指出,对于绝经前患者的辅助治疗,可考虑他莫西芬/AI+OFS,均为1类推荐。我国2018年的《中国早期乳腺癌卵巢功能抑制临床专家共识》与2019年的《中国抗癌协会乳腺癌诊治指南与规范》均基于上述研究建议:绝经前患者可以使用OFS的内分泌治疗,高复发风险患者、中危复发风险且STEPP评分较高患者推荐OFS+AI/他莫西芬。
卵巢功能保护
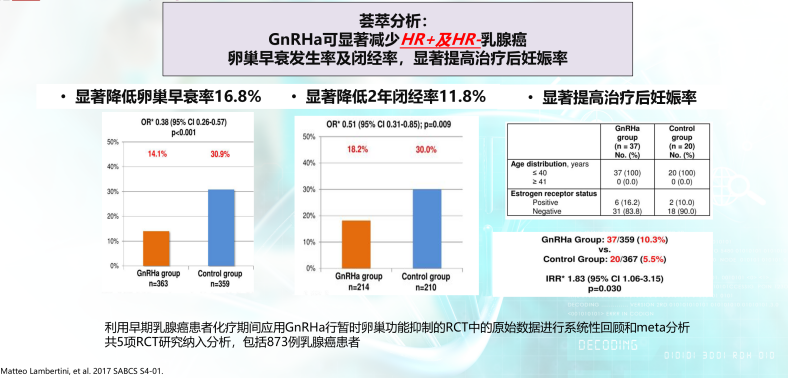
2017年SABCS公布的一项卵巢保护的荟萃分析,经过筛选共纳入了5项RCT研究,包括PROMISE/POEMS/OPTION/ZORO/Moffitt-led trial研究,共873例患者,研究发现早期乳腺癌患者化疗期间使用GnRHa行暂时的卵巢功能抑制,可显著减低HR+及HR-患者卵巢早衰率16.8%,显著降低2年闭经率11.8%,提高了治疗后妊娠率。2019年v1版NCCN指南去掉HR阴性患者的限制,指出对于接受辅助化疗的绝经前乳腺癌患者,无论患者HR状态为何,使用GnRHa治疗进行卵巢抑制,能够保护卵巢功能,减少化疗引起闭经的可能性。
化疗的选择
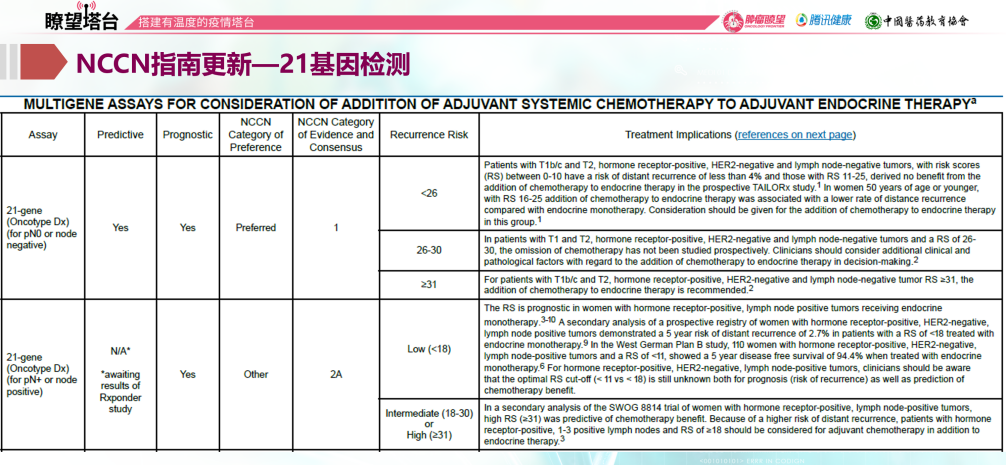
TAILORx研究基于21基因评分对绝经前患者化疗的选择提出了指导,研究入组了既往参加Oncotype患者10273例,其中RS 0-10分的患者仅接受内分泌治疗,RS≥26分的接受化疗+内分泌治疗,RS 11-25分的患者随机分为内分泌治疗组和化疗+内分泌治疗组。结果显示RS 11-25分人群中两组患者iDFS无显著差异。然而亚组分析显示,对于年龄≤50岁,且RS 16-25分人群,使用化疗+内分泌治疗可以降低患者复发风险。因此,NCCN指南对21基因检测指导进行了修订,指出RS<26的HR阳性、HER2阴性、淋巴结阴性的T1 b/c或T2人群中,一般无需化疗;然而若患者≤50岁,且RS 16-25,则化疗+内分泌治疗疗效更佳。
既往一系列研究对早期绝经后患者不同内分泌治疗的延长策略进行了组合和探索,最长内分泌治疗可达15年,其中AERAS研究对5年AI或他莫西芬+AI后序贯5年+5年阿那曲唑对DFS的改善最为突出。结果显示,继续延长5年阿那曲唑可改善DFS 7.5%,HR 0.548;无远处转移生存(DDFS)改善2.9%,HR 0.514,均具有显著优势。2018年EBCTCG meta分析显示,接受5年他莫西芬治疗的患者,延长5年AI可以降低33%的复发风险;接受过AI辅助治疗的患者,延长5年AI可降低20%的复发风险。
2018年ASCO AI延长治疗指南指出,淋巴结阳性乳腺癌患者推荐AI延长治疗最长至10年,淋巴结阴性患者结合风险因素酌情延长不超过10年;延长内分泌治疗的获益来自于第二乳腺癌和对侧乳腺癌;是否延长辅助内分泌治疗应由医患双方共同决定。2019年CBCS指南建议对Ⅱ期淋巴结阳性,已接受5年AI的患者可以再延长3-5年;Ⅲ期患者5年内分泌治疗后可优选AI继续治疗5年。2020年v1版NCCN 指南也作了类似修订,对于AI治疗5年且诊断时已绝经患者,推荐维持AI延长的时间由5年改为3-5年。
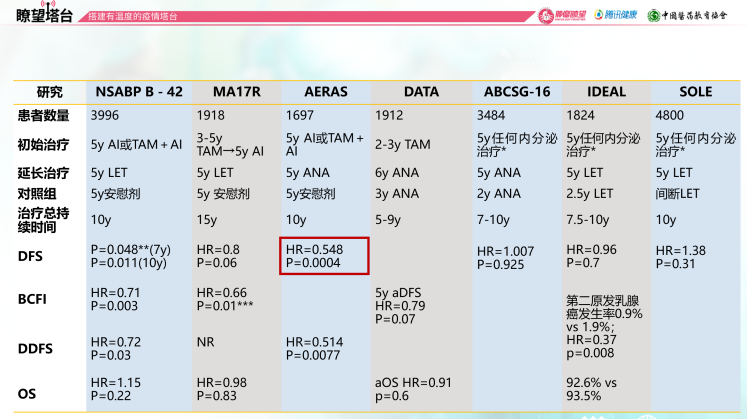
对于患者远期复发风险可以考虑使用CTS5评估分析,该指标纳入了患者淋巴结、肿瘤大小、肿瘤分期以及患者年龄等因素。于ATAC研究中首次提出,并于BIG 1-98研究中得到验证,评分越高的患者远期复发风险越高。2019年《中国抗癌协会乳腺癌诊疗指南与规范》首次将该指标写入指南:对于Ⅱ期淋巴结阴性且接受过内分泌治疗的HR阳性乳腺癌患者,延长内分泌治疗需要个体化实施,应根据临床指标或CTS5综合考虑患者远期风险、耐药性和耐受性进行决策。
?
晚期HR阳性患者以氟维司群为基础联合靶向药物或AI逐渐成为新的选择。PALOMA-3研究将既往内分泌治疗12个月内复发患者或ABC内分泌治疗中进展患者分别予以氟维司群+安慰剂或氟维司群+palbociclib,结果显示氟维司群+palbociclib较联合安慰剂组提高OS 6.9个月,达34.9个月,激素治疗敏感患者OS提高10个月。
MONARCH-2研究对内分泌治疗耐药或内分泌治疗进展的患者分别予以氟维司群+ Abemaciclib和氟维司群+安慰剂,结果显示联合用药组较氟维司群单药组中位PFS由显著提升,分别为16.4个月vs 9.3个月。MONALEESA-3研究评估了氟维司群联合Ribociclib一线治疗的疗效,结果显示氟维司群单药组mPFS为19.2个月,mOS为40个月;联合用药组为mPFS 为33.6个月,mOS尚未达到。基于上述研究,国内外指南对氟维司群联合CDK4/6抑制剂一线治疗、TAM治疗失败后二线治疗进行了推荐。

氟维司群联合AI的疗效也得到证实,SWOG 0226研究对绝经后晚期一线乳腺癌患者随机分组后,分别予以氟维司群联合阿那曲唑或阿那曲唑单药。结果显示,总体人群使用阿那曲唑联合氟维司群较阿那曲唑单药,中位PFS分别为15个月和13.5个月,中位OS分别为49.8个月和42.0个月,无论PFS或OS都有显著提升。因此,NCCN指南指出,HR阳性/HER2阴性绝经后或绝经前接受卵巢切除或抑制患者一线治疗方案新增氟维司群±非甾体AI(阿那曲唑、来曲唑)。

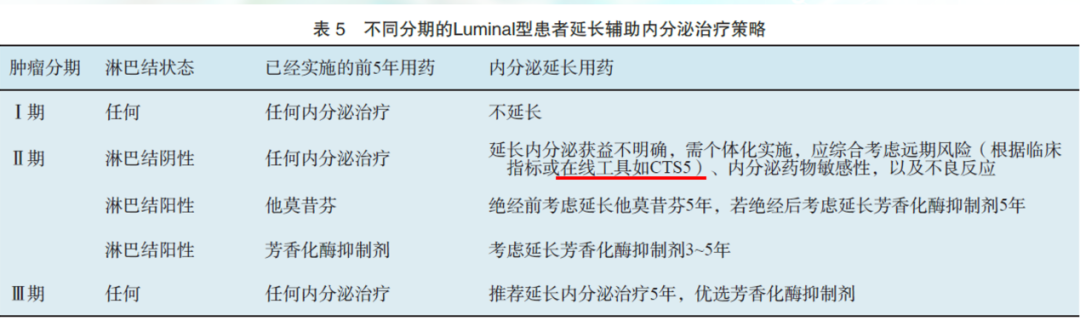
精准治疗是乳腺癌治疗发展的热点方向之一,对于HR阳性乳腺癌,已明确PIK3CA和BRCA两个生物标志物。SOLAR-1研究对既往AI治疗进展HR阳性、HER2阴性乳腺癌患者进行PIK3CA检测,并随机分组分别给予氟维司群+PIK3CA抑制剂Alpelisib和氟维司群+安慰剂。PIK3CA突变组结果显示两组中位PFS分别为11.0个月和5.7个月,氟维司群联合Alpelisb可降低此类人群35%的复发风险,证实了PIK3CA作为生物标志物的可行性。
OlympiAD研究则对TNBC或HR阳性、HER2阴性患者人群中gBRCA突变进行随机分组,分别予以奥拉帕利或医生选择的单药治疗(TPC),结果显示与TPC相比,奥拉帕利显著提高总体人群中位PFS,分别为7.0个月vs 4.8个月,患者复发风险降低42%,印证了BRCA检测的必要性。故2020年v2版NCCN指南对所有乳腺癌患者均推荐BRCA基因检测;对HR阳性、HER2阴性患者推荐PIK3CA检测,对于三阴性乳腺癌患者推荐进行PD-L1的检测,以便精准指导用药。
HER2+乳腺癌靶向治疗的“新探索”
授课专家:潘跃银教授
HER2阳性乳腺癌一线采用曲妥珠单抗帕妥珠单抗联合化疗已成为标准方案。二线治疗可选择T-DM1或小分子TKI联合化疗,2019年CSCO指南对拉帕替尼/吡咯替尼联合卡培他滨的二线抗HER2治疗进行了推荐。而三线治疗则面临着不同的小分子靶向药物的选择,其中奈拉替尼在2019年ASCO公布的NALA研究中显示出了其独到的优势。
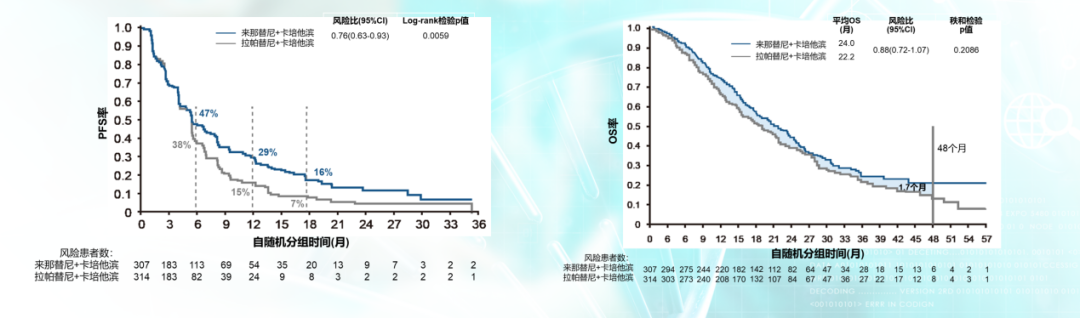
NALA研究对2线及以上无症状或脑转移HER2阳性乳腺癌患者随机分为两组分别予以奈拉替尼+卡培他滨和拉帕替尼+卡培他滨。结果显示,奈拉替尼对比拉帕替尼,18个月PFS率分别为16% vs 7%,降低24%的复发风险;平均OS分别为24个月vs 22.2个月,降低12%的死亡风险,且在中国人群中以及脑转移亚组人群中体现了更显著的优势。故NCCN 2020 v3版乳腺指南推荐奈拉替尼+卡培他滨用于HER2阳性乳腺癌的后线治疗,从而改变抗HER2治疗的临床实践。
?
对于三阳性乳腺癌,既往靶向治疗联合内分泌治疗探索颇多,2019年ASCO公布的一项真实世界临床研究对三阳性乳腺癌真实世界诊疗方案进行对比。结果显示化疗联合抗HER2治疗及内分泌联合抗HER2治疗取得较好的结果,中位OS分别46.8个月 vs 56.0个月,所以该研究中内分泌联合靶向治疗效果不差于化疗联合靶向治疗。
2019年ESMO公布的MonarcHER研究探索了CDK4/6抑制剂abemaciclib+曲妥珠单抗±氟维司群 vs 曲妥珠单抗+标准化疗治疗三阳性晚期乳腺癌的疗效。该研究入组了2线及以上既往接受过T-DM1和紫杉醇治疗的患者,30%以上为亚太地区患者,超过50%发生了内脏转移。研究结果显示,abemaciclib+曲妥珠单抗±氟维司群 vs 曲妥珠单抗+标准化疗中位PFS延长了2.6个月,为8.32个月vs5.69个月,HR 0.673,P=0.0506;ORR有明显改善,分别为32.9% vs 13.9%;目前OS尚不成熟,abemaciclib+曲妥珠单抗±氟维司群初步显示了优势趋势,预计2021年公布初步结果。基于以上研究,国内外指南均建议三阳性乳腺癌可以考虑内分泌治疗±抗HER2治疗,成功挑战了传统的化疗+靶向地位,未来可期。

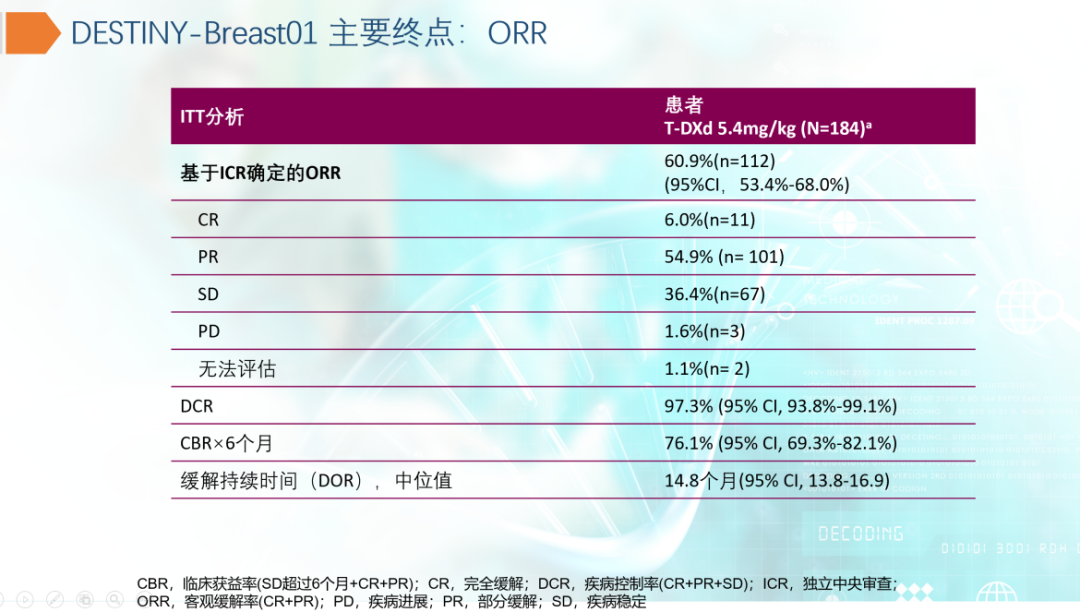
ADC药物是抗HER2治疗中一颗冉冉升起的新星,除已于中国上市的T-DM1外,近年T-DXd也取得长足发展。T-DXd由曲妥珠单抗和拓扑异构酶抑制剂Deruxtecan衍生物结合而成,具有高度选择性、有效载荷穿膜特性及旁观者效应。其Ⅰ期研究结果显示,抗HER2治疗进展后晚期乳腺癌,T-DXd ORR可达59.5%。DCR达93.7%,PFS达22.1个月,因其旁观者效应的存在,不良反应有所上升。Ⅱ期DESTINY-Breast01研究对T-DM1经治的HER2阳性乳腺癌患者使用T-DXd的疗效进行探索,结果显示ORR高达60.9%,中位DOR 14.8个月,DCR高反应率超过97%,中位PFS为16.4个月,OS尚未成熟。由于DESTINY-Breast01研究的良好表现使之迅速通过了FDA的批准和指南的推荐,NCCN指南2020 v2版建议用于晚期HER2阳性乳腺癌患者。未来,T-DXd 三线对比标准治疗的Breast02研究,二线对比T-DM1的Breast03研究,以及HER2低表达人群的Breast04研究正在进行,期待能进一步改变临床实践。
三阴性乳腺癌突破化疗的“新选择”
授课专家:陈前军教授
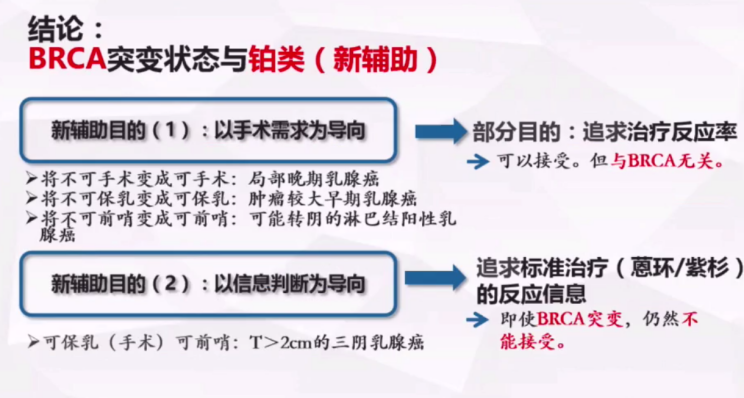
早期乳腺癌新辅助治疗BRCA突变的TNBC是否需要增加铂类?对于服务于手术和药敏平台信息判断的患者人群的选择有何不同?2019年 St.Gallen共识投票中,绝大多数专家认为普通的TNBC新辅助治疗无需加铂,但若存在BRCA突变阳性,则需要联合铂类。2020年v3的NCCN指南则根据局部肿瘤的控制需求指出,新辅助治疗中,包括BRCA突变在内的患者不建议常规使用铂类,若需要更好的局部控制,方可考虑增加铂类,故NCCN指南认为TNBC患者新辅助治疗是否增加铂类与患者BRCA基因突变与否无关。
众所周知,铂类药物可以与DNA结合形成损伤区域,DNA可以通过剪切与修复恢复正常功能,而BRCA突变后的癌细胞存在同源重组修复缺陷(HRD),故使用铂类药物可以导致细胞死亡。2010加拿大的一项新辅助回顾分析显示,BRCA突变患者使用铂类pCR率可达83%,而2012年德国GBG前瞻性新辅助研究使用蒽环紫杉的pCR率仅为35.8%,因此JCO甚至提出了基于BRCA突变进行“靶向化疗”的概念,以上是St. Gallen指南推荐BRCA突变患者使用铂类的理论基础。
回顾2014年新辅助化疗的GeparSixto研究,在蒽环紫杉的基础上增加铂类,价值并不明显。堪萨斯大学2018年的SWOG S9313研究指出,无论DFS还是OS,即使患者为BRCA野生型,高HRD评分也可以预测蒽环治疗的敏感性,故BRCA突变可能对蒽环使用也存在指导作用。2019年SABCS上公布的TBCRC 031研究,进一步比较了gBRCA突变患者使用顺铂或AC方案的疗效,结果印证了BRCA突变患者对蒽环和铂类同样敏感。
因此,St.Gallen指南在蒽环紫杉新辅助治疗增加铂类的意见是否过于仓促?到底如何考虑增加铂类?NCCN指南的新辅助治疗目的主要以手术为导向追求治疗反应率,GeparSixto研究与CALGB 40603研究均显示蒽环紫杉基础上增加铂类pCR率提高14%~16%。故新辅助治疗可以增加铂类提高反应率,但与BRCA是否突变无关。St.Gallen指南的新辅助治疗则以信息判断为导向追求标准治疗的敏感信息,CREAT-X研究指出,TNBC患者使用蒽环紫杉方案后,non-pCR患者可以通过卡培他滨强化辅助治疗提高DFS;而假如在蒽环紫杉的基础上增加铂类判断患者的药物敏感性,则会带来决策困境,pCR患者为敏感患者,non-pCR患者复发风险较高,均需要强化治疗。所以即使患者BRCA突变,增加铂类对后续敏感信息判断也无明显作用。
?
已有研究证实,BRCA基因突变对铂类、蒽环具有敏感作用,因此辅助治疗在蒽环基础上增加铂类需要进一步的证据证实。因为目前循证证据的缺乏,NCCN指南指出以蒽环为基础的方案增加铂类后的化疗线序和紫杉醇的选择仍无定论,故不推荐辅助治疗增加铂类。
?
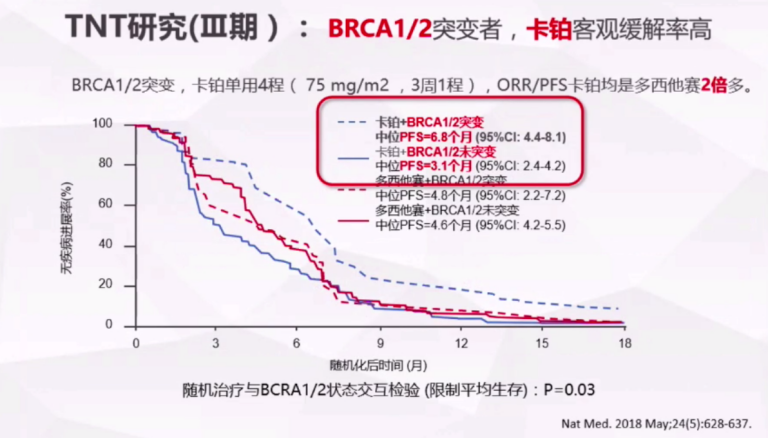
TNT研究指出,BRCA1/2突变的患者,卡铂的中位PFS为6.8个月,多西他赛为4.8个月;未突变者的使用卡铂和多西他赛的中位PFS分别为3.1个月和4.6个月,对指南有明确指导作用。ABC4指南指出,晚期TNBC患者,既往辅助/新辅助治疗含有蒽环或紫杉,则可以考虑使用卡铂;若患者未BRCA突变的晚期乳腺癌,既往使用过蒽环或紫杉,则含铂方案为优选方案。
肿瘤细胞DNA损伤存在BRCA同源重组修复和PARPi剪辑修复两条通路,BRCA突变后无法通过同源重组修复,此时使用PARPi则可以阻断另一条修复通路,DNA损伤后会合成致死。奥拉帕利在BRCA突变乳腺癌的Ⅱ期临床研究结果显示,≥1线的ORR可达41%,≥3线的ORR仍达到13%,Ⅲ期的OlympiAD也进一步证实了奥拉帕利的疗效。另一个PARPi Talazoparlib Ⅲ期临床研究显示,Talazoparlib较医生选择化疗可以延长中位PFS 3个月,达到8.6个月,进展风险降低46%。基于上述研究,ABC4指南、CSCO-BC指南、NCCN指南均推荐BRCA突变的晚期乳腺癌使用PARPi。因此,晚期TNBC已经进入了分类治疗的时代,PD-L1阳性患者可以使用免疫治疗,BRCA突变患者使用铂类和PARPi,二者均无则可使用化疗或参与临床研究。

?
问:晚期TNBC患者是否需要常规检测BRCA基因?
陈前军教授:BRCA基因对晚期TNBC患者指导价值很大,可以有效指导铂类或PARPi的使用,故建议进行常规检测。
问:患者62岁,乳腺癌术后放化疗,来曲唑8年后肺转移,行化疗后使用氟维司群。请问氟维司群耐药性如何?假如耐药后有何措施?
孙涛教授:FIRST研究显示使用氟维司群TTP是23.4个月,然而其中混杂了一半以上既往未使用过内分泌治疗的患者,所以仅能以此作为耐药时间的参考。若发生转移后可以考虑联合CDK4/6抑制剂、mTOR抑制剂,若存在PI3K突变则可使用PI3K抑制剂。
问:患者纤维瘤样化生性癌,淋巴结转移,正在进行化疗。请问此类癌种复发率如何,有何更好的治疗方法?
潘跃银教授:纤维瘤样化生性癌的生物学行为与其化生后表现有直接关系,乳腺癌化生性癌总体危现程度相对较高,治疗手段与其分子分型密不可分。若患者在基层医院,则建议转入上级医院进行完整的病理评估,再根据分期何分型进行相应治疗。
问:BRCA突变的TNBC患者,术后5年对侧复发。患者早期参与过奥拉帕利临床研究,因为未揭盲,不清楚是否使用过奥拉帕利,此时应如何用药?
孙涛教授:因患者所参与奥拉帕利研究未揭盲,无法评估是否可以使用奥拉帕利。患者存在的对侧乳腺转移病灶可以考虑再次使用奥拉帕利,但是费用较高,也存在不确定性;也可以考虑含铂两药方案化疗,如GP方案。
陈前军教授:首先患者需要排除是原发还是继发乳腺癌,从现有的信息看患者复发间隔时间长,存在BRCA突变,原发的可能性较大,此时可以以治愈为目的进行标准的治疗,包括手术、蒽环紫杉的化疗等。
问:除了21基因,还有哪些方法可用于早期乳腺癌近期或远期复发风险评估?可及性如何?
陈前军教授:我个人认为,国内现有的基因检测工具并未得到很好的临床验证,对临床的指导作用还有待进一步证实。
问:基因检测对于晚期乳腺癌的价值如何?有哪些常见的指标?
潘跃银教授:目前临床常常提及的基因检测包括BRCA、HER2等是必须的。而NGS的检测则需要谨慎考虑,该检测目前多用于临床研究的耐药性机制检测或目前无标准治疗方案的患者的检测。再者,目前国内的NGS检测资质也参差不齐,临床选择更需谨慎。
问:乳腺癌术后2年,ER阳性、PR阳性、HER2阴性、Ki-67 10%,托瑞米芬治疗后子宫内膜增厚,改用他莫西芬仍存在子宫内膜增厚,达到3.3cm。患者47岁未绝经,是否可以调整内分泌治疗方案?
孙涛教授:围绝经期患者使用他莫西芬或托瑞米芬是非常适合的,然而患者出现了子宫内膜增厚,根据既往妇科指南意见,若患者单纯子宫内膜增厚不伴有不规则阴道流血,可以继续使用原方案,若伴发不规则阴道流血或子宫肌瘤、卵巢囊肿,则应更换方案。建议患者进行宫腔镜检查,排除伴发疾病的可能,绝经前患者子宫内膜增厚一般不建议更改治疗策略。
问:炎性乳腺癌经新辅助化疗后,局部红肿完全消失,病灶基本消失,是否有保乳的可能性?
耿翠芝教授:无论是否新辅助治疗,炎性乳腺癌是保乳的禁忌症之一,因为皮肤癌性淋巴管内的癌栓无法解决,故不建议保乳。









 京公网安备 11010502033352号
京公网安备 11010502033352号