导读:“乳腺癌”和“加减乘除”,这两个来自医学和数学领域、看似风马牛不相及的概念,被放到一起会产生什么火花?治疗方案可以进行怎样的优先排序?结果是否对患者治疗有益?请跟随云南省肿瘤医院聂建云教授的步伐,一起进行“乳腺癌治疗过程中加减乘除”的探索。
1.1单药递进
对于ER+乳腺癌患者来说,与无辅助系统治疗相比,辅助内分泌治疗能显著降低ER+乳腺癌的复发风险。他莫昔芬(TAM)的出现,揭开了内分泌治疗的序幕,5年TAM辅助治疗成为了乳腺癌患者辅助治疗的标准方案。
2011年EBCTCG对20项研究进行荟萃分析,共纳入21457例绝经前早期乳腺癌患者,其中10645例为ER+,发现5年TAM治疗可显著降低ER+早期乳腺癌患者15年复发率和乳腺癌死亡率。尽管TAM辅助治疗5年可以降低患者的疾病复发风险和死亡风险,但TAM治疗也可能增加患者子宫内膜癌的发病风险,并且引发其他不良反应。
ATAC研究10年随访结果显示,阿那曲唑能显著改善绝经后乳腺癌患者的无病生存并体现出延续效应,且显著降低术后近期和远期两大复发高峰,提高早期治愈率。BIG1-98研究结果也显示,5年来曲唑可较TAM显著降低31%的近期(随访2年)复发风险,降低27%的远处转移风险。ATAC、BIG1-98、IES等研究以及随后的Meta分析均揭示了5年AI治疗的优势,5年AI治疗较5年TAM辅助治疗可明显改善患者的无病生存,降低复发风险,确立了AI作为绝经后早期乳腺癌患者辅助治疗标准方案的地位。
研究者进一步发现,完成5年内分泌治疗之后的患者,20年复发风险仍持续存在。即使N分期为N0/N2期早期乳腺癌患者,20年远处复发率仍达22%-52%。对于HR+晚期乳腺癌患者来说,氟维司群的出现为其带来了更多获益,FALCON研究证实,在未经内分泌治疗的HR阳性晚期乳腺癌患者中,氟维司群(500mg)较三代AI延长了PFS 16.6个月 vs. 13.8个月(HR=0.797,P=0.0486),差异有统计学意义。在无内脏转移的患者中,氟维司群可显著延长PFS达22.3个月,较AI显著延长8.5个月。因此,国内外各大指南中均推荐氟维司群作为HR阳性晚期乳腺癌内分泌治疗的一线选择。
从既往的TAM到AI再到如今的氟维司群,随着研究不断进展,HR+乳腺癌患者的治疗药物在不断丰富,更让患者获益不断。
1.2单药延时强化
既往TAM仍是乳腺癌内分泌治疗的基石,5年TAM 是标准治疗方案。随着研究不断地开展,我们对HR+乳腺癌患者治疗的认识也不断加深,延长内分泌治疗时间成为了又一提高患者生存的重要手段。
ATLAS研究结果显示,辅助TAM延长治疗至10年,能显著降低患者复发率和死亡率;aTTom研究显示辅助TAM延长治疗至10年,显著降低患者复发率(绝对获益4%)。NSABP-B33研究显示,TAM治疗5年后延长5年TAM或AI都可获益;MA.17研究显示N+人群更能从延长AI治疗中获益。至此,我们可以看出5年TAM辅助治疗时间已不能满足患者生存需求。
随后,NSABP-B42、DATA、IDEAL等研究提示TAM→AI满5年的LN+患者可考虑延长AI治疗,MA.17R研究中10年AI辅助治疗DFS的获益更多在于其预防效应,进一步凸显了延长AI辅助内分泌治疗的重要性,因此,NCCN指南2020 V4版对HR+早期乳腺癌患者的治疗进行了延长推荐。具有高危因素者,AI 或 TAM 应延时至10年。
1.3联合OFS
为进一步降低早期绝经前患者体内雌激素水平,更好的保护患者的卵巢功能,卵巢功能抑制(OFS)治疗手段也在发生着改变,药物去势这一治疗方案随之出现,并作为辅助化疗的代替方案被进行研究。2005年~2009年的ZEBRA、IBCSG 8研究及2005年的EBCTCG荟萃分析结果显示,辅助OFS的疗效不劣于辅助CMF。2009年~2015年的INT0101、ZIPP研究和EBCTCG荟萃分析分别对OFS联合TAM的辅助内分泌治疗方案疗效及安全性进行了验证和研究,但是由于研究设计的不足,未能解答OFS在辅助内分泌治疗中的地位和疗效。
2017年的SOFT研究8年随访结果公布,证实OFS+TAM/AI能显著改善整体人群的DFS,随后SOFT/TEXT联合分析、ASTRRA研究进一步证明了这一结果并对具体人群进行了分析。基于此,2016年V2版NCCN指南、2017年V3版NCCN指南将“TAM±OFS*5年或AI+OFS*5”年作为I类证据,2020年V4版NCCN指南也将“OFS+AI/TAM*5年”作为绝经前HR+早期乳腺癌的标准治疗方案,2020版CSCO BC指南也根据患者初始治疗时的状态对其进行了分层并做出了相应推荐,对于具有高危因素患者,OFS+AI或OFS+TAM 5年治疗成为Ⅰ级推荐。
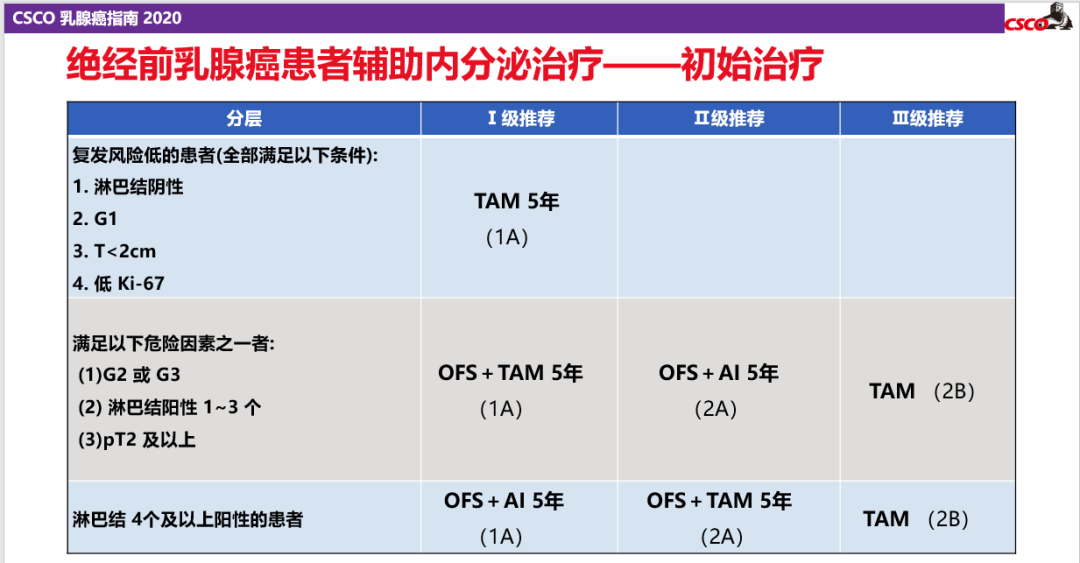
1.4联合内分泌靶向药物
随着治疗靶点逐渐被发现,mTOR抑制剂、CDK4/6抑制剂、PI3K抑制剂/Akt抑制剂、HDAC抑制剂等相关药物出现,并开启了内分泌治疗新时代。
mTOR 调控异常与肿瘤发生密切相关,抑制 mTOR 通路可以有效阻断各种生长因子异常信号的传导,从而抑制肿瘤发生和发展。其代表药物为依维莫司,BOLERO-2 研究首次在大型研究中证实了依维莫司联合依西美坦对内分泌耐药乳腺癌患者的疗效,该研究还提示依维莫司对AI治疗引起的骨丢失具有明显的保护作用。2012年FDA和EMEA分别批准依维莫司联合依西美坦用于非甾体类抗炎药(NSAI)治疗失败晚期HR+/HER2-乳腺癌绝经后妇女的治疗,依维莫司率先开启了MBC内分泌联合靶向治疗新模式。此外,PrE010、TAMRAD等研究中依维莫司与氟维司群/TAM进行联合,也取得了较好的结果。
PI3K信号传导在肿瘤生长、增殖、存活中起作用,PIK3CA突变导致PI3K过度活化,会促进肿瘤细胞增殖、侵袭和转移,而在ER+/HER2-的乳腺癌中,PIK3CA基因突变的发生率则高达40%。其代表药物为Alpelisib,基于SOLAR-1全球Ⅲ期随机、双盲、安慰剂对照的试验结果,2019年FDA批准Alpelisib用于内分泌治疗耐药HR+/HER2-存在PIK3CA突变的晚期乳腺癌的治疗。

表观遗传调控异常所导致的基因表达状态的改变,在肿瘤发生和发展中是一个普遍现象。既往HDAC抑制剂的代表性Ⅱ期研究结果显示,恩替诺特与依西美坦联合用于绝经后雌激素受体阳性且非甾体芳香酶抑制剂治疗后进展的乳腺癌患者时,可延长其无进展生存期与总生存期。
由江泽飞教授牵头的西达本胺联合依西美坦治疗激素受体阳性晚期乳腺癌的Ⅲ期临床试验——ACE研究结果显示,西达本胺联合依西美坦可以改善晚期乳腺癌患者的无进展生存期(PFS)并且安全可控,为这部分患者提供一种新的治疗选择。

CDK4/6作为新的治疗靶点,其抑制剂能够靶向抑制促进肿瘤细胞生长的关键效应蛋白激酶CDK4/6,阻止肿瘤细胞通过G1期-S期的检查点,阻滞细胞周期,靶向抑制肿瘤细胞增殖。PALOMA-2、MONALEESA-2、MONARCH-3、MONALEESA-7等几项研究结果均显示,晚期一线治疗中应用CDK4/6i+ET,患者PFS均大于24个月。可以说,CDK4/6抑制剂改变HR+/HER2-晚期乳腺癌治疗格局,各指南/共识也均推荐CDK4/6抑制剂联合方案作为优选。
回顾既往,内分泌治疗经历了从单药到联合治疗的变迁,随着内分泌治疗加法的“加数”不断增加;放眼未来,乳腺癌内分泌治疗百年之路,节节升!
对于接受新辅助治疗未达到pCR的HER2阳性患者,KATHERINE研究进一步给出了新辅助靶向治疗后的辅助治疗策略,研究结果显示,新辅助以曲妥珠单抗为基础的靶向治疗未达到pCR患者,术后换用T-DM1可以改善患者的iDFS和DDFS,使患者在辅助治疗中从T-DM1中获益。

2020年ASCO大会公布ALTERNATE研究结果,该研究探索了手术前给予氟维司群或阿那曲唑与氟维司群的新辅助内分泌治疗是否优于阿那曲唑,以缩小肿瘤并阻止其生长。但该研究未能达到主要研究终点,研究结果显示,单药氟维司群或联合阿那曲唑较单药阿那曲唑,均不能显著提高ER+/HER2-绝经后局部晚期乳腺癌的ESDR率。因此,新辅助内分泌治疗NSAI单药已足够。
既往调查研究结果显示,在中国,一线化疗的应用比例远高于指南推荐。美国一项真实世界研究结果显示,绝经后HR+/HER2-转移乳腺癌患者一线化疗中断率显著高于一线内分泌治疗。此外,荷兰、法国等国家真实世界研究结果数据显示,一线内分泌治疗较一线化疗显著延长HR+/HER2-转移乳腺癌患者中位PFS和OS。
2019 年一项发表于Lancet Oncology的Meta分析汇总了2000年1月1日至2017年12月31日期间,ER+/HER2阴性的绝经后转移性乳腺癌一线和或二线使用化疗±靶向治疗和内分泌治疗±靶向治疗的所有的Ⅱ期和Ⅲ期随机对照临床研究,结果显示,未发现任何治疗方案优于哌柏西利+来曲唑,且哌柏西利+来曲唑安全性更优。该研究结果支持HR+/HER2-绝经后晚期乳腺癌患者,内分泌+靶向联合方案作为一线和或二线治疗的选择。
既往研究提示,对于ER(+)、N0、早期乳腺癌患者,可从21基因评分中预测10年远期复发风险和化疗获益,其中评分越大,10年复发风险越高,越能从化疗中获益。反之,对于低危患者,可考虑避免化疗。
近年来,多基因检测的出现使患者的个体化治疗有了更好的指导依据,目前除了常用的21基因复发风险评分,还有70基因复发风险评分(MammaPrint)和50基因复发风险评分(PAM50)等。TAILORx研究提示,RS评分在11-25之间的HR+ / HER2- / AN-早期乳腺癌患者来说,可以豁免化疗;MINDACT研究进一步提示70基因检测进一步让部分临床高危患者豁免化疗。放眼未来,可通过多基因检测使更多患者实现豁免化疗,从而得到更为精准的治疗。
KRISTINE是一项比较T-DM1联合帕妥珠单抗与赫帕双靶联合传统化疗进行新辅助治疗疗效的随机、多中心、开放标签、III期研究,共入组444例年龄≥18岁、HER2阳性、II-III期可手术、肿瘤直径>2cm、ECOG PS 0或1、基线LVEF≥55%乳腺癌患者,并将其随机分为两组,分别给与6周期的T-DM1+帕妥珠单抗(T-DM1+P,n=223)和帕妥珠单抗+曲妥珠单抗+多西他赛+卡铂(TCH+P,n=221)的新辅助治疗,术后两组患者分别进行12周的T-DM1+帕妥珠单抗和曲妥珠单抗+帕妥珠单抗辅助治疗。
KRISTINE研究结果提示,T-DM1联合帕妥珠单抗新辅助治疗的疗效未超越赫帕+传统化疗新辅助治疗,但3-4级不良事件更少,耐受性更好;T-DM1+P组的3年长期结局与TCH+P组相似,患者报告结局更好。
APT研究进一步提示,复发风险较低的患者在抗HER2治疗下具有良好的预后,因此,低风险患者无需过强的辅助化疗,亦无需新辅治疗。此外,首个Ⅰ期HER2阳性乳腺癌接受T-DM1单药辅助治疗的TBCRC 033 (ATEMPT)研究提示,T-DM1在治疗相关毒性(CRT)方面较TH更少(25% vs 36%),且3年DFS率优于TH方案(97.5% vs 93.2%),证明了T-DM1在此类人群辅助治疗中的良好效果。因此,对于接受靶向治疗的复发风险较低的HER2阳性乳腺癌患者来说,靶向治疗可以不选择与化疗进行联合。
KEYNOTE-522是第一个探究帕博利珠单抗作为新辅助/辅助治疗药物治疗早期TNBC疗效的含安慰剂的前瞻性Ⅲ期临床随机对照试验,共纳入1174例年龄≥18岁、新诊断T1c N1-2期或T2-4 N0-2期TNBC患者,随机(2:1)接受新辅助治疗帕博利珠单抗+化疗或安慰剂+化疗。新辅助治疗后,患者接受根治性手术,如有适应症则接受放射治疗,随后接受辅助性帕博利珠单抗或安慰剂治疗,直到复发或出现不可接受毒性。
该研究结果提示,帕博利珠单抗联合含铂类的新辅助化疗方案在早期TNBC中的应用,可使患者的pCR(ypT0/Tis ypN0)增加13.6%(P=0.00055),亚组分析显示,无论基于PD-L1状态如何,患者均能从中获益。
IMpassion130 研究也是免疫治疗领域的又一进展,该研究入组了902例不可手术的局部晚期或者转移性乳腺癌患者,随机(1:1)接受一线阿特利珠单抗联合白蛋白紫杉醇治疗对比安慰剂联合白蛋白紫杉醇治疗,主要研究终点包括PFS和OS。研究结果显示在ITT人群中,研究组和对照组的PFS分别为7.2个月和5.5个月;而在PD-L1阳性的患者群体中,PFS的差异更明显,研究组和对照组的PFS分别为7.5个月和5.0个月,而且都有显著的统计学差异,所以说患者PFS的获益是非常明确的。第二次OS中期分析,在PD-L1+人群中仍观察到中位OS由18个月延长至25个月(HR=0.71)。
以上两项研究可以见证,免疫治疗对于乳腺癌患者而言,精选人群会有更多获益,有了免疫治疗的神助攻,患者的在生存期不断延长。
SoFEA研究入组了阿那曲唑或来曲唑治疗进展后的患者,并将其分为三组对比,分别是氟维司群负荷剂量组,氟维司群负荷剂量联合阿那曲唑组及依西美坦单药组。研究结果显示三组的疗效相当,氟维司群+AI的疗效未优于AI。
随后在EFECT研究中,研究者比较了氟维司群负荷剂量和依西美坦25mg/d对于经非甾体AI治疗失败的(辅助中或晚期一线后)绝经后激素受体阳性的晚期乳腺癌患者的疗效。研究结果显示,氟维司群负荷剂量组与依西美坦组疗效相当,主要研究终点中位TTP无统计学差异,次要研究终点0RR,CBR也无差异。因此,同一机制或信号通路的联合,不一定带来获益效应叠加。
今年ASCO大会上公布的PARSIFAL研究对比了哌柏西利联合氟维司群对比联合来曲唑在内分泌敏感的HR+/HER2-转移性乳腺癌疗效,研究共入组486例患者,1:1随机接受“哌柏西利+氟维司群”或“哌柏西利+来曲唑”治疗,直至出现疾病进展或不可耐受的毒性。分层因素包括内脏累及与否以及初诊Ⅳ期或复发转移。主要研究终点PFS,次要研究终点:预设亚组分析PFS、OS安全性等。
研究结果显示,中位随访32个月,256名患者出现了疾病进展,102名患者出现了OS事件。在ITT人群中,氟维司群+哌柏西利治疗患者的中位PFS为27.9个月,来曲唑+哌柏西利治疗患者的中位PFS为32.8个月(HR=1.13,P=0.321),两组患者PFS均无统计学差异。两组OS事件的发生率均为21%;预计3年总生存率,氟维司群+哌柏西利组为79.4%,来曲唑+哌柏西利组为77.1%(HR=1,P=0.986)。ORR或CBR也相当。安全性方面,3~4级不良事件的发生率两组相当。
该研究提示,一线内分泌敏感晚期乳腺癌,氟维司群联合哌柏西利PFS未优于来曲唑联合哌柏西利,总生存无区别。进而提示我们单药对比的优势,不一定转化为联合的优势,甚至可能带来副反应方面的劣势。
TRAIN-2研究共入组了438例患者Ⅱ-Ⅲ期、LVEF≥50%、既往未接受任何化疗且年龄大于18岁HER2阳性乳腺癌患者,并将其按照1:1随机分为两组,非蒽环组患者接受9周期紫杉醇+卡铂(P+C)+HP双靶的治疗,蒽环组患者接受3周期FEC+HP双靶,序贯6周期紫杉醇+卡铂+HP双靶的治疗,新辅助治疗之后所有患者接受手术治疗。主要终点为pCR,次要终点为安全性、RFS、OS等。
研究结果显示,无论是否使用蒽环类药物,均获得较高的pCR率,蒽环组为67%,非蒽环组68%,两组之间统计学无差异,亚组分析无论是肿瘤大小、淋巴结状态、激素受体状态、还是年龄大小、两组之间的pCR都没有看到明显的差异。3年随访结果显示,含蒽环类药物方案并未使患者EFS和OS受益。EFS亚组分析结果提示,无证据表明高风险HER2阳性乳腺癌患者需要使用蒽环类药物。安全性方面,含蒽环治疗组的患者增加发热性中性粒细胞减少症和心脏毒性风险更大,含蒽环组的患者有1%的患者出现了新发的急性白血病。此研究结果提示HER2阳性这一亚型乳腺癌,去蒽环可以考虑!
综上所述,临床实践中乳腺癌患者多种多样,医生的治疗方案也应根据患者的情况适当进行“加减乘除”以避免不良事件的发生,只有具体分析患者情况,并根据实际情况做出适时调整,才能实现患者的精准化治疗。
博士,主任医师,博士研究生导师
加拿大麦吉尔大学博士后
云南省肿瘤医院乳腺三科科主任
云南省高层次人才医学学科带头人
云南省有突出贡献优秀专业技术人才(“省突”)津贴获得者
中国抗癌协会青年理事
中国CSCO乳腺癌专家委员会常务委员
中国CSCO患者教育专家委员会常务委员
中国医促会乳腺疾病专业委员会常务委员
中国医药教育协会乳腺疾病专业委员会常务委员
中国抗癌协会乳腺癌专业委员会委员
云南省医师协会乳腺癌专业委员会主任委员
云南省抗癌协会乳腺癌专业委员会副主任委员
主持国家自然科学基金课题3项,国际合作课题、省部级课题及厅局级课题20余项。课题分别获云南省科技进步一等奖、三等奖、云南省卫生科技成果二等奖。发表医学论文50余篇,SCI论文11篇。主编医学专著2部,参编医学专著7部,参与中国《CSCO乳腺癌诊疗指南》的编写。





 京公网安备 11010502033352号
京公网安备 11010502033352号