编者按:脑转移和脑膜转移的治疗是ALK阳性NSCLC全程管理中的棘手问题,既往临床研究中常将有症状脑转移排除在外,导致这部分患者治疗依据的匮乏。塞瑞替尼独树一帜、力破重围,成为目前唯一拥有针对有症状、进展期脑转移前瞻性临床研究的ALK抑制剂,ASCEND-7研究结果显示了塞瑞替尼对有症状进展期脑转移和脑膜转移的惊艳疗效。?
2020年6月8日“tALK show:点亮ALK阳性NSCLC之光”直播活动“ALK阳性NSCLC脑转移/脑膜转移治疗新格局”中,由湖南省肿瘤医院邬麟教授、上海交通大学附属胸科医院姜丽岩教授主持,中国医学科学院肿瘤医院郝学志教授、同济大学附属上海肺科医院郑迪教授、华中科技大学协和医院孟睿教授、哈尔滨医科大学附属肿瘤医院孟庆威教授等分别详细讲述并评论了塞瑞替尼对脑转移/脑膜转移的治疗突破。
郑迪教授:期待塞瑞替尼450mg剂量下颅内疗效的真实世界研究数据
塞瑞替尼750mg治疗ALK阳性NSCLC出现AE较多,约20%患者会减量,患者耐受性较差。
ASCEND-8研究发现塞瑞替尼450mg随餐减量增效且更安全,塞瑞替尼也以此剂量(450mg随餐)在中国上市。
ASCEND-8研究旨在研究塞瑞替尼在不同剂量下的药代动力学PK参数,安全性和疗效,研究将患者按照1:1:1的比例分为750mg空腹组、600mg随餐组和450mg随餐组,观察安全性和疗效。
研究结果显示,450mg随餐服用和750mg空腹的稳态血药浓度相当,同时塞瑞替尼450mg随餐服用减少了药物对胃肠道局部刺激、安全性更好、耐受性更高,大大提高了治疗依从性,疗效较750mg空腹剂量增加的趋势, ORR为78.1%vs75.7%, PFS从12.2个月提高到随访超过25个月但中位PFS仍未到达。
美国一项真实世界临床研究中,51例有脑、肝、骨转移的ALK阳性NSCLC克唑替尼耐药患者使用塞瑞替尼治疗,在20例脑转移患者中 14例肿瘤得到应答,ORR为70%。不同剂量塞瑞替尼的疗效有所差异,450mg剂量组ORR(83.3%)高于750mg和600mg剂量组。

问题: 您在临床实践中使用塞瑞替尼450mg剂量下治疗脑转移的疗效如何?
郝学志教授:临床实践中450mg随餐剂量适宜,患者耐受性好、胃肠道反应少。个人临床经验中有3例脑转移患者采用塞瑞替尼450mg治疗均有效。
孟睿教授:ASCEND-4、ASCEND-7、 ASCEND-8研究均显示塞瑞替尼750mg和450mg对脑转移的良好疗效。目前临床中多采用450mg随餐剂量,脑转移患者会先行MGPA评分,全面评估患者KPS评分、脑转移病灶数量、颅外病灶控制情况、广泛转移肿瘤负荷等情况。评分高的患者颅内病灶数目更少,塞瑞替尼一方面可消除病灶水肿,另一方面可减少新发脑转移病灶。另外,在靶向药物治疗的基础上可以考虑早期局部放疗介入,对广泛脑转移且有严重合并症,例如脑疝的患者,会在口服塞瑞替尼将病灶控制、症状减轻的情况下介入放疗。目前,就不同的放疗模式而言,优选局部放疗,全脑放疗的副反应较大,治疗地位日趋降低。
ALK阳性患者脑转移发生率高,可高达40%以上,且转移病灶数量多,多为有症状、进展期脑转移。但是,由于脑转移患者状态差、生存期短,且不良反应风险增加,常被临床研究排除在外。
凡纳入脑转移患者的临床研究需明确描述对以下三种脑转移类型的入组标准:
1)经治疗/稳定脑转移:患者在脑部接受过脑转移,且脑部病灶(CNS)在影像学上是稳定的;
2)有症状进展期脑转移:患者在入组研究时出现新的或进展期脑转移;
3)脑膜转移:患者在软脑膜腔出现转移灶,(而不是在实质)。
目前大多数临床研究仅纳入第一类患者,临床急需针对有症状、进展期脑转移和脑膜转移的临床治疗依据。
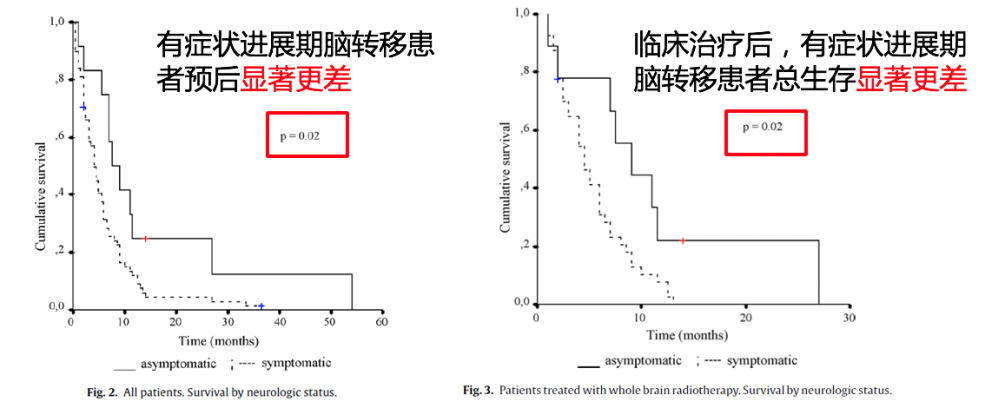
既往对476例患者的长期随访结果显示,有症状脑转移中位OS仅4个月,疾病控制率仅40%,较无症状、稳定期脑转移预后更差(OS 7.5个月,DCR 80%)。比较生存曲线,有症状、进展期脑转移患者,或接受治疗后有症状、进展的脑转移患者,总体预后都更差。

塞瑞替尼是唯一挑战有症状进展期脑转移的ALK抑制剂
在ASCEND-2中,基线脑转移中20%为有症状、进展期脑转移患者,尽管研究纳入了这部分预后差的患者,但颅内DCR达到80%,75.2%的患者颅内病灶有所减小。
ASCEND-7研究是唯一专门针对进展期、有CNS症状的脑部和/或脑膜转移的临床研究。入组的患者必须确认颅内病灶处于进展期。如果患者之前接受过放疗,入组时颅内病灶稳定,则不纳入分析。
ASCEND-4研究和ALEX研究同为一线治疗研究,两个研究人群基线差异大,结果无法直接比较。ASCEND-4研究的脑转移患者中,有症状进展期的脑转移患者比例高达60%,而ALEX研究中纳入的均为稳定期(≥2周)、无症状脑转移患者,塞瑞替尼750mg研究者评估和第三方评估的中位PFS分别为14个月和11个月,阿来替尼研究者公布PFS为28个月。
尽管纳入了有症状进展期脑转移,ASCEND-4研究中塞瑞替尼对脑转移患者的短期、长期疗效与ALEX数据结果仍然很相近,全脑转移人群IORR、可测量脑转移人群IORR和基线可测量颅内病灶人群IDOR在ASCEND-4研究中分别为46.3%、72.7%和16.6%,在ALEX研究中分别为59.0%、81.0%和17.3%。
图4. ASCEND-4研究和ALEX研究中脑转移患者疗效
ASCEND-7:首个100%纳入有症状、进展期脑转移患者的ALK前瞻性临床研究
ASCEND-7研究是唯一专门针对进展期、有CNS症状的脑部和/或脑膜转移的全球II期临床研究,研究分5组,由于入组患者的基线各不相同,可作为5个单臂研究来解读:
-
组1:既往接受过脑放疗但未控制住,既往接受过ALK抑制剂治疗;
-
组2:既往未接受过脑放疗,但接受过ALK抑制剂治疗;
-
组3:既往接受过脑放疗但未控制住,未接受过ALK抑制剂治疗;
-
组4:未接受过脑放疗,也未接受过ALK抑制剂治疗;
-
组5:脑膜转移。

ASCEND-7研究对进展期、有症状脑转移的定义有三点:
- 新诊断的活动性脑转移患者,可以是从未接受过脑部治疗或先前接受过脑转移治疗的患者;
- 之前进行过全脑放射治疗的脑部病变仅在与首次可获得的放疗后影像学评估相比,实体病灶的大小有明确增加(囊性成分的病变不被认定为进展)时才被视为活动性脑转移;
- 仅当脑部肿瘤增大的性质明显归因于肿瘤成分病变而非放射效应时,才可以认为先前用立体定位放射手术治疗的脑病变是活动性的。
ASCEND-7研究结果提示,ALK阳性NSCLC患者无论之前是否接受过克唑替尼治疗,无论之前是否接受过脑部放疗,塞瑞替尼750mg空腹对活动性脑转移都显示出抗瘤疗效。
ASCEND-7研究第3组分析结果显示,既往有脑部放疗但放疗未能控制住,无ALK抑制剂治疗史的患者经塞瑞替尼治疗后,全身疗效ORR可达50%,颅内ORR为16.7%,可测量脑转移患者的颅内ORR为28.6%。无论是全身、颅内或可测量脑转移的颅内DCR均能达到70%左右,其中可测量脑转移颅内DCR甚至可达85.7%,中位PFS 未达到,预估6个月无事件概率66.7%,中位OS未达到,预估12个月无事件概率75.0%。
第4组既往无脑部放疗和ALK抑制剂的患者,采用塞瑞替尼治疗后,疗效更佳,总体ORR可达59.1%,颅内ORR达40.9%,可测量颅内ORR达51.5%,中位PFS7.9个月,预估6个月无事件概率63.4%,中位OS未到,预估12个月无事件概率77.9%。
问题: 基线差异巨大的临床研究,结果是否无法直接进行比较?塞瑞替尼的临床研究中纳入了大量有症状脑转移的患者,基于这一情况,随着对塞瑞替尼众多临床研究数据的进一步挖掘,您如何评估塞瑞替尼在颅内病灶的疗效?
郝学志教授:脑转移患者病情相对复杂,脑转移数量、大小、症状、有无脑水肿等均会对治疗结果产生影响,因此,有症状进展期脑转移因可能需要放疗的早期介入,为免贻误治疗而常被排除在外。个人认为脑转移数量大于3个患者的可考虑TKI 治疗,不建议局部放疗或手术。
目前不同临床研究基线不同,无法客观地比较孰优有劣。二代ALK抑制剂对脑转移均有效,较一代克唑替尼入血脑屏障能力更强,临床可见CR的病例报道。
孟庆威教授:基线差异大的临床研究不能进行直接比较,ASCEND-7研究纳入的是有症状、进展期脑转移,而ALEX研究纳入的是稳定期脑转移,此外,临床试验开展时间、研究终点等差异均是无法比较的原因之一。
遵循循证医学证据,ASCEND-7研究是目前唯一100%纳入有症状进展期ALK阳性脑转移患者的前瞻性临床研究,是临床应用的合适依据。
孟睿教授:塞瑞替尼是目前唯一拥有对有症状、进展期ALK阳性脑转移和脑膜转移治疗前瞻性临床研究数据支持的ALK抑制剂。同时,塞瑞替尼也提供了不同ALK变体的疗效,塞瑞替尼对恶性程度高的V3变体亚型疗效优于克唑替尼,阿来替尼无相应数据。因此,总体来说,不论是从疾病严重程度还是从进展期脑转移的纳入范围来看,塞瑞替尼是目前可提供最充足临床数据的ALK抑制剂。在ALK抑制剂联合放疗方面,放疗联合的时机和放疗模式,都会影响脑转移最终疗效。目前对脑转移的临床治疗,我们需要更多前瞻性或真实世界研究数据。
邬麟教授:脑转移临床情况较为复杂,目前没有头对头比较不同ALK抑制剂的临床研究。塞瑞替尼已在国内获批一线适应症,对初治脑转移患者,塞瑞替尼一线治疗相信会积累更多的临床经验。
问题: 临床上如何发现脑转移患者?是否有预判的机制?临床上如何处理有症状进展期脑转移?ASCEND-4和ASCEND-7的研究设计是否更贴近临床真实情况?这两个研究的结果是否有临床参考意义?
郝学志教授:肺癌患者随诊过程中定期检查可发现脑转移。驱动基因阳性患者更易出现脑转移,尤其是ALK阳性患者经一线克唑替尼治疗后脑转移高发。但是,若一线应用塞瑞替尼或阿来替尼后,脑转移的发生可能会延迟。脑转移的治疗手段包括靶向药物、放疗、手术等,对于单个较大的脑转移,在应用TKI缓解症状的基础上,给予局部治疗例如放疗、手术也是一个较好的选择。
孟庆威教授:通过脑部增强MRI为主的影像学检查可发现脑转移,驱动基因阳性患者更易出现脑转移,尤其是ALK阳性NSCLC患者。有症状进展期脑转移的治疗非常复杂但疗效甚微,治疗手段包括化疗、靶向药、放疗、手术等,各种治疗手段的应用时机、应用次序尚无定论。对于ALK阳性脑转移,及时应用靶向药物可使病情得到快速缓解。不同地区的医疗条件不一,基因检测结果较慢时,可考虑先放疗。塞瑞替尼是目前唯一一个拥有有症状、进展期脑转移患者临床数据的ALK抑制剂,对临床治疗具有重要的参考意义。
克唑替尼治疗1年,超过40%的患者发生了脑转移。克唑替尼治疗中,发生脑转移的患者生存更短。使用克唑替尼的患者发生脑转移后患者的症状负担总体较高,所经历的不良症状大幅增加,最常见的症状为疲乏、气促、恶心呕吐和头疼。脑转移对患者生活质量、健康相关经济负担造成较大影响,因此,脑转移的治疗至关重要。
目前NCCN指南中,针对克唑替尼治疗进展后出现有症状的脑转移,删除了原来“继续克唑替尼治疗”的治疗选项,改为换用二代ALK抑制剂

目前二线临床研究中,塞瑞替尼750mg治疗脑转移的颅内ORR为39.4%,DCR为84.8%,颅内持续应答时间达12.8个月,阿来替尼600mg治疗脑转移的颅内ORR为42.6%,DCR为85.3%,颅内持续应答时间为10.8个月,两个药物对脑转移的疗效数据类似。
ASCEND-7研究中,按既往有无接受过放疗及ALK抑制剂治疗,将有症状进展期脑转移患者分为4组,第5组为脑膜转移组。其中第1组为既往有脑部放疗但放疗未控制住,经ALK抑制剂治疗的患者,塞瑞替尼治疗后颅内ORR为26.2%,可测量脑转移患者颅内ORR为39.3%,PFS7.2个月,OS达24个月。第2组既往无脑部放疗,经ALK抑制剂治疗的患者中,颅内ORR为20.0%,可测量脑转移患者颅内ORR为27.6%,PFS5.6个月,OS未达到。
?
问题: 对于克唑替尼耐药脑转移的患者,您认为二代ALK抑制剂的疗效如何?在克唑替尼治疗期间发生脑转移的人群中,您什么时候会考虑换药?基线有脑转移的患者,您是否会考虑优先使用二代ALK抑制剂?鉴于以上数据,即使基线无脑转移的患者,您是否认为应该将二代ALK抑制剂放在一线使用?
孟睿教授:一线克唑替尼中位PFS约11个月,约40%-50%的患者出现脑转移进展。在既往二代药物不可及的情况下,临床将进展模式区分为局部进展、广泛进展,来进行药物选择,对局部进展患者继续原药,对颅内病灶进行放疗。但是,目前二代药物可及,尤其像塞瑞替尼对有症状、进展期脑转移和脑膜转移具有相当不错的疗效,不论对控制脑部病灶还是预防脑转移都有效果。因此,目前对局部进展患者,若脑转移病灶较大,采用局部治疗手段后会将全身治疗更换为二代ALK抑制剂,例如塞瑞替尼或阿来替尼。对于脑转移患者的放疗模式,目前全脑放疗地位证据级别越来越低,会更多的选择局部放疗。
ALK阳性患者脑转移比例高,初诊时可高达40%,同时,脑转移部位数量在4个以上的占50%。基线有脑转移的患者,放疗是局部治疗手段,无法预防脑转移的再发。因此,建议优先考虑二代ALK治疗有脑转移的肺癌患者。对于V3变体,三代劳拉替尼疗效最佳,但目前不可及,二代ALK抑制剂例如塞瑞替尼也有良好的疗效。对于V1变体,推荐塞瑞替尼和阿来替尼,不考虑劳拉替尼。此外,根据患者是否脑疝等危急情况合理介入治疗。
放疗和靶向药的应用时机应根据GPA评分和是否潜在可治愈等因素作个体化考虑。可参考EGFR阳性脑转移的研究结果,对无症状脑转移可以先用TKI,随后考虑放疗介入。若患者GPA评分高,仅有颅外孤立肺内病灶或骨转移病灶,可以先用局部治疗,优先考虑脑SBRT,并用局部手段处理颅外孤立病灶,达到潜在治愈的可能。若患者GPA评分低则倾向全身治疗为主,脑部放疗置后。放疗手段中,优先选用SBRT。
郑迪教授:对克唑替尼耐药脑转移的患者,二代ALK抑制剂的疗效优秀。在克唑替尼治疗期间发生脑转移的人群中,越早换药越好。基线有脑转移的患者,应优先使用二代ALK抑制剂。提倡好药先用,无论是否有脑转移,都建议尽早使用二代ALK抑制剂。
塞瑞替尼拥有唯一针对脑膜转移的临床研究数据。ASCEND-7脑膜转移组中,尽管纳入的患者基线情况较差,塞瑞替尼治疗中位PFS仍能达到5.2个月,中位OS达7.2个月。吴一龙教授指出,塞瑞替尼对脑膜转移的疗效能达到20%,已经是一个惊艳结果!未来对于一开始伴有或在治疗过程出现脑膜转移的患者,可考虑将塞瑞替尼作为治疗首选。

图9. ASCEND-7研究脑转移/脑膜转移组疗效
在泛亚ESMO晚期NSCLC指南中,对ALK阳性、无症状脑转移的患者,推荐首选TKI而推迟放疗。在初诊既有脑转移的患者中,可以考虑一线使用ALK抑制剂,推荐使用塞瑞替尼或阿来替尼。脑膜转移的病人可选择血脑屏障透过率较高的二代药物。
放疗是脑转移的常见处理手段,放疗的使用是否会影响ALK抑制剂的疗效呢?ASCEND-1研究显示,接受过放疗的患者使用塞瑞替尼后颅内DCR仍能达65.3%,与未接受放疗患者类似(65.2%),可见无论有无脑部放疗史,塞瑞替尼对脑转移的疗效均十分优秀。需要注意的是,患者既往是否接受过ALK抑制剂治疗及不可测量脑转移病灶比例可能会造成疗效的差异。
克唑替尼治疗1年后,超过40%的患者发生了脑转移。塞瑞替尼750mg空腹剂量下,ASCEND-1一线研究中仅22%的患者在进展时发生脑转移,ASCEND-5多线研究中,基线无脑转移的人群中,仅15%在进展时发生脑转移。
体外试验IC50结果显示,塞瑞替尼的亲和力是克唑替尼的20倍,是阿来替尼的12.7倍,在所有ALK抑制剂中亲和力最强!在体外肺癌细胞实验中,塞瑞替尼所需的抑癌浓度显著低于克唑替尼,小鼠动物实验也展现出比克唑替尼更强的抑癌能力和更低的抑癌浓度。
药物的CSF/IC50对脑膜转移灶的疗效具有重要意义,从塞瑞替尼和阿来替尼的CSF/IC50值来看,塞瑞替尼最高,说明塞瑞替尼在脑脊液中的抗肿瘤活性非常强。
?
?
问题: 临床上遇到脑膜转移患者,您是否会一线使用塞瑞替尼?在临床中如何将放疗和ALK抑制剂结合使用, 使患者生存获益最大化?CSF:IC50是否有参考意义?
郝学志教授:二代ALK抑制剂是脑转移患者一线治疗的重要选择。对于脑膜转移患者,通过鞘内注射在获取脑脊液NGS检测的同时进行药物注射也是传统经典的治疗方式,对顽固的、症状明显的脑膜转移患者,可以尝试鞘内注射甲氨蝶呤或地塞米松,有可能获得短期缓解,也有研究报道培美曲塞鞘内注射可获得较好的疗效。
对于无症状脑转移,放疗的地位日趋后移,脑转移病灶较小且无脑水肿的患者多先应用TKI治疗,脑转移病灶大且有严重脑水肿的尽早放疗。
临床前数据会受代谢、毒性等因素影响,并不能完全体现对临床的意义。
郑迪教授:塞瑞替尼是目前唯一拥有有症状、进展期脑转移、脑膜转移治疗数据的二代ALK抑制剂,研究结果可作为临床应用依据。
临床实践应以临床疗效数据为指导依据,对于细胞学数据保持审慎的态度。
孟睿教授:脑膜转移中,头颅MRI无法检测到的和MRI中有局灶性病变的应区别对待,若影像学中无局灶性转移灶,仅有临床症状,并通过脑脊液检查确诊的脑膜转移,放疗的干预十分有限,只能依靠ALK抑制剂或加用抗血管生成药物缓解脑膜病变。若有脑膜局灶性病灶,可采用放疗局部处理。全脑放疗毒副反应大,目前临床应用很少。因此,塞瑞替尼目前具有针对脑膜转移的数据,会一线应用。
放疗的局部介入能使脑转移患者得到更好的生存获益。较大的脑转移病灶会在应用TKI缩小病灶后进行放疗,以减少放疗毒副反应,SBRT等放疗手段可以极大地减少对周围脑组织的损伤。
有关TKI应用后的放疗毒副反应,对于肺部病灶,应用克唑替尼后进行肺部病灶放疗易引发严重的间质性肺炎,因此,会暂停克唑替尼后做同步放化疗,完成后继续克唑替尼治疗。目前没有相应临床研究数据报道塞瑞替尼是否会引发严重间质性肺炎,临床中尝试了个例治疗,相对较安全。对于颅内病灶放疗联合ALK抑制剂,克唑替尼、塞瑞替尼和阿来替尼都没有数据报道同步治疗是否会增加放疗不良反应,但可以看到前期的脑部放疗不会影响塞瑞替尼的疗效,但会使阿来替尼的疗效下降。临床应用中,对SRS局部放疗没有任何影响,全脑放疗目前临床应用越来越少,没有文献报道ALK抑制剂对全脑放疗是否会引起严重不良反应。
姜丽岩教授总结:好药先用,推荐一线使用塞瑞替尼等二代ALK抑制剂。对于一线克唑替尼进展的患者,尽早换用二代ALK抑制剂。对于脑转移患者,可根据有无症状、病灶弥漫或局灶等因素个体化结合放疗手段。目前ASCEND系列研究多为750mg剂量,国内获批450mg随餐剂量,希望在真实世界研究中拥有更多450mg剂量的研究数据。
邬麟教授总结:塞瑞替尼ASCEND系列研究从二线到一线,从西方人群到亚洲人群,再到有症状、进展期脑转移和脑膜转移,提供了很多的疗效和安全性数据支撑,未来的临床应用值得进一步探索。
参考文献:
1. J Thorac Oncol. 2017;12(9):1357-13673. Adv Ther. 2017;34:1145–11564. Lung Cancer. 2009;63(1):140-5.5. Presentation by Laura QM Chow and Fabrice Barlesi ESMO 20196. Cancer Treatment Reviews. 2017;54:122–1317. J Clin Oncol. 34:123-129.8. J Med Econ. 2015; 18:312-22.9. Shaw AT, et al. SNO. 2014; Oral presentation # BM-3210. J Clin Oncol 34:123-129.11. Lancet Oncol. 2016;17(4):452-463.12. J Clin Oncol. 34:4079-408513. Biochim Biophys Acta. 2013;1835:61–7514. Cancer Discov. 2014;4:662–7315. J Med Chem. 2014;57:4720–44.16. Acta Pharm Sin B. 2015;5:34–7.17. Future Oncol. 2014;10:1925–3918. Cancer Discov. 2014;4:662–73.19. Lancet Oncol.2018 Jan;19(1):e43-e55.





 京公网安备 11010502033352号
京公网安备 11010502033352号