摘要翻译:姜金星
编者按:在本次ASH年会上与2020年5-8日在线上举行。在这项血液学“盛宴”汇聚了全球各地的血液肿瘤专家和学者,多项重磅级的研究公布了临床数据。既往骨髓瘤治疗已取得许多进展,但诸多关于BCMA CAR-T在骨髓瘤中的研究公布结果,亮点颇多。《肿瘤瞭望》继续邀请上海仁济医院侯健教授进行分享。
一、#129:Universal: An Allogeneic First-in-Human Study of the Anti-Bcma ALLO-715 and the Anti-CD52 ALLO-647 in Relapsed/Refractory Multiple Myeloma
在人体中首次运用抗CD52及抗BCMA同种异体CAR -T细胞治疗复发/难治性多发性骨髓瘤
旨在评估ALLO-715,一种基因修饰的抗B细胞成熟抗原(BCMA)CAR Ttm 细胞产品,通过破坏TCR-α恒定区基因从而降低移植物抗宿主病(GvHD)发生的风险的效果。
这是一项非盲的I期临床研究。纳入至少3线治疗失败的患者,包括蛋白酶体抑制剂、免疫调节剂及抗CD38单抗在内的既往治疗方案后复发难治性多发性骨髓瘤(R/RMM)成年患者,且患者必须对最后一线治疗耐药。入组患者先接受淋巴细胞剔除(LD)的预处理,然后输注4种不同药物剂量(DL)中的一种CAR-T细胞,实验方案为ALLO-715 3+3剂量递增方案:40*10^6,160*10^6,320*10^6和480*10^6的CAR T。淋巴细胞剔除方案有以下几种:
①FCA:氟达拉滨(F)90 mg/m2,环磷酰胺(C) 900 mg/m2,和ALLO-647 (A) 13mg*3天;
②FCA+:氟达拉滨(F)90 mg/m2,环磷酰胺(C) 900 mg/m2(剂量相同),但ALLO-647 (A+)剂量加到30mg*3天;
③CA:剔除氟达拉滨,环磷酰胺(C) 900 mg/m2,和ALLO-647 (A) 13mg*3天。

截至2020年7月8日,共纳入19名病人,其中15名接受3种药物剂量水平(DL)的ALLO-715:3名患者接受DL1(3 FCA and 0 CA); 7个患者接受DL2 (4 FCA and 3 CA); 5个患者接受DL3 (3 FCA and 2 CA)。截止观察时没有患者接受FCA+方案或 ALLO-715 DL4剂量。患者在入组时都处于疾病的进展阶段(既往治疗线数为5(范围:3-11))且31.6%的患者在国际分期系统(ISS)中处于III期,入组前均进行预处理。其中有1例患者既往接受过自体干细胞移植治疗。
52.6%(10/19)的患者属于细胞遗传学高风险,26.3%(5/19)的患者出现髓外疾病的表现。
在安全性方面:①最常见的3级及以上的不良反事件为贫血(42.1%),中心粒细胞减少(41.2%),淋巴细胞减少(29.4%)以及血小板减少(29.4%)。4例病人发生3级及以上的感染,其中3例是3级,包括细小病毒B19,葡萄球菌以及肺炎,目前已治疗好转。第4例是5级,发生在一个急性进展的难治性骨髓瘤患者ALLO-715输注后的第8天,第1天表现为非中性粒细胞减少的发热和多灶性肺炎,血培养、痰培养均阴性,该患者最终进展为呼吸衰竭而死亡。我们考虑这例死亡病例与预处理相关。
②在4例病人(24%)中发生细胞因子释放综合征,3例是1级事件,1例是2级事件,都在没有应用托珠单抗和糖皮质激素的情况下治疗好转。
③截止观察终点时没有关于ALLO-715相关剂量限制性毒性(DLTs)、神经毒性(ICANS)以及移植物抗宿主病的报道。

有效性方面:在中位2(0-10)月随访观察中,15个患者能够进行疗效评估(这些患者接受ALLO-715治疗后,至少应进行一次反应评估或者在首次反应评估才考虑中断治疗)。
①ALLO-715(DL3)剂量与疗效呈正相关,根据国际骨髓瘤工作组(IMWG)标准3/5病人缓解 (60%, 95% CI 14.7, 94.7)。在接受DL3 FCA的患者中,2/3有反应(其中包括1 例sCR and 1例 VGPR)。所有有反应的DL3患者经历了至少1次VGPR,并且通过局部MRD检查达到了最小残留疾病(MRD)阴性。
②在第14天时都可初步观察到反应。4/5(80%)的反应者在截止观察终点时仍处于缓解状态。通过qPCR可以观察到所有剂量的ALLO-715细胞扩增。
这些早期数据提示ALLO-715和ALLO-647有着可控的安全性。ALLO-715在复发难治性多发性骨髓瘤患者(R/RMM)的同种异体治疗表现出一定的临床有效性,并且临床效果与细胞剂量呈正相关。
近年来,以BCMA为治疗靶点的CAR-T细胞技术在R/R MM的治疗领域取得了巨大进步,但是安全性有待进一步提升。该研究通过基因修饰、优化预处理方案及改进CAR结构提升同种异体BMCA CAR-T治疗的安全性和有效性,值得相关人员参考。但我们同时注意到了一例与预处理相关的死亡事件,这同样提示我们对于CAR-T治疗而言,前期对于患者状态的评估,输注细胞前处理(包括免疫调节类药物等)都十分重要,即使目前的药物在副作用程度大幅度下降的情况下。
二、#134.Phase 1/2 Study of the Safety and Response of P-BCMA-101 CAR-T Cells in Patients with Relapsed/Refractory (r/r) Multiple Myeloma (MM) (PRIME) with Novel Therapeutic Strategies
采用新的治疗策略P-BCMA-101 CAR-T细胞治疗复发/难治性多发性骨髓瘤的安全性和有效性的1/2期临床研究
探究P-BCMA-101是用于复发/难治性多发性骨髓瘤的安全性和有效性
这项1/2期临床试验针对既往接受过至少3线治疗包括蛋白酶体抑制剂、免疫调剂药物或双重耐药的复发难治性多发性骨髓瘤(RRMM)患者,研究中不需要预设BCMA表达的水平。通过患者血液单采收集T细胞,然后在标准的3天环磷酰胺(300mg/m2/d)/氟达拉滨(30mg/m2/d)淋巴细胞剔除方案后静脉输注P-BCMA-101。
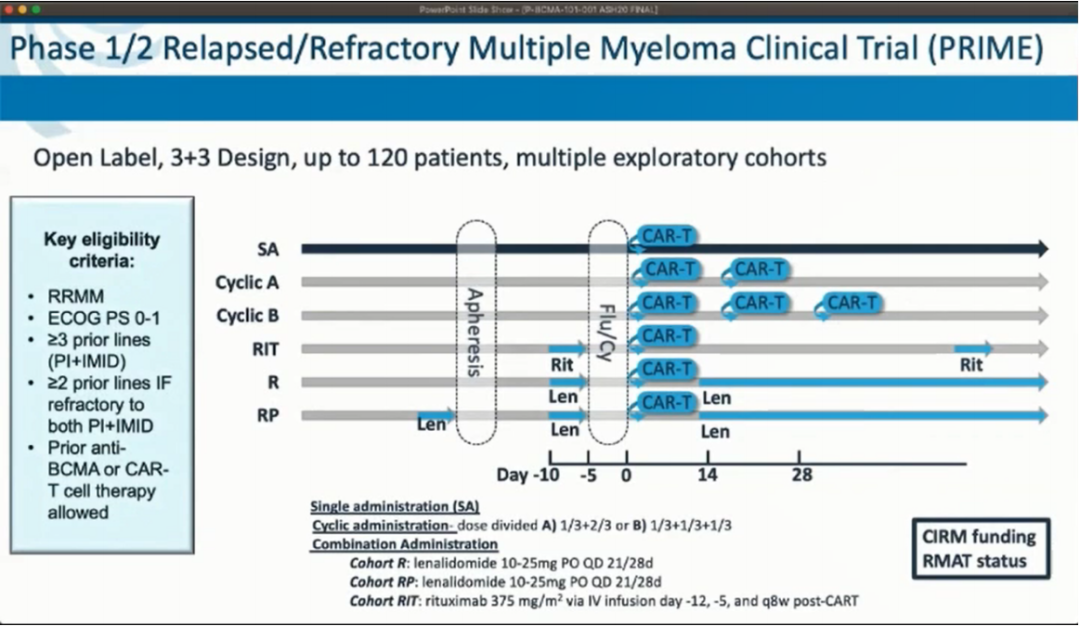
截至2020年6月30日,研究共纳入43例患者接受了P-BCMA-101治疗(男/女:67%/33%,中位年龄60岁)。患者既往曾接受多次治疗方案(中线治疗线数为7[范围:3-18]),100%患者既往接受蛋白酶体抑制剂和IMiD,93%接受达雷木单抗和58%接受自体干细胞移植治疗。这项研究最初是作为一项剂量递增临床试验,在标准淋巴细胞剔除方案之后每例输注0.75-15×106个细胞/kg P-BCMA-101。随后对采用新治疗策略的探索性队列进行评估。采用改进的生产工艺以中位剂量为0.75×106细胞/kg进行给药,包括:以两周为周期的P-BCMA-101输注;在淋巴细胞剔除前后分别给予利妥昔单抗或来那度胺,以防止抗CAR抗体的产生和提高T细胞的活力;以及单次给药。
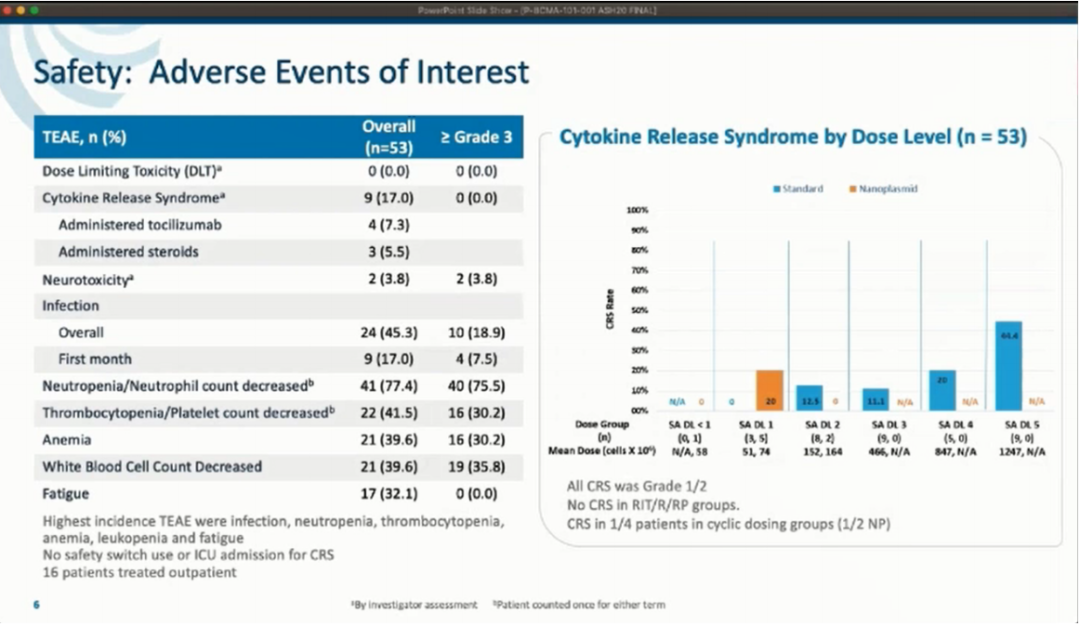
安全性方面:整组应用CAR-T细胞产品的安全性很好,这归因于Tscm细胞的逐渐扩增(2-3周达到峰值,而大多数CAR-T细胞则是3-7天)。
①细胞因子释放综合征(CRS)仅见于17%的患者,仅有1例为3级,发现1例可能的神经毒性(短暂的意识混乱)。同样,CRS标志物的峰值也不高(所有患者的IL-6水平最高为1631pg/mL,比其他CAR-T产品引起的严重CRS的水平低一个数量级)。只有3例患者需要托珠单抗治疗,没有患者需要入住ICU、启动安全预案或其他激进的措施。目前尚未出现与P-BCMA-101相关的患者死亡、DLTs或意外/脱靶毒性。
②除此之外,最常见的不良事件是细胞减少/感染和全身症状(≥3级中性粒细胞减少79%,血小板减少30%,贫血30%),与目前用淋巴细剔除竭的CAR-T细胞研究中所预期的一致。
有效率方面:①34名患者在初始剂量增加期间单次给药的总有效率(ORR)为57%。我们没有观察到明确的剂量反应曲线,但发现在较低剂量下有更好的反应,因此我们使用改进的生产工艺对额外的队列进行研究,重点关注采用目前剂量范围的最低剂量的效果。
②4例患者随后接受了周期性给药、利妥昔单抗、来那度胺或单独给药(所有患者均在截止观察前2个月内用P-BCMA-101进行治疗)。到目前为止,所有患者都有快速反应(100%ORR),并且所有反应都在持续中。
通过PCR在血液中检测到的循环中P-BCMA-101细胞量与Tscm的高百分比一致,在输注后2-3周达到峰值,并在1.5年内可检测到。治疗反应与细胞扩增的Cmax和AUC相关,但与给药剂量无关。
目前的临床数据与前期动物试验研究结果一致,新型的P-BCMA-101设计能够带来显著的疗效和低毒性,甚至可用于门诊用药。在低剂量下同样有效,且通过改进制造方式能够明显改善疗效。
P-BCMA-101是一种以BCMA为靶点的自体嵌合抗原受体T细胞(CAR-T),由高比例的高品质干性记忆性T细胞组成。P-BCMA-101是使用一种新的基于转座子的系统piggyBac(编者注:在我们研究某种疾病的发病机制或者某种药物的作用靶点时,经常需要建立目的基因过表达或基因敲除的细胞模型,目前构建稳转细胞株及部分敲除细胞株最常用的方式之一是慢病毒法,慢病毒因其可以转染几乎所有种类的细胞,且在转染后可以整合到细胞的基因组而长期表达的优势,是目前较为主流的构建方法,但慢病毒构建的稳转细胞株相对于野生型没有生长优势;此外,慢病毒对目的基因的载量也有限。因此,寻找一种高效简便可替代慢病毒法的方法显得尤为重要。转座子的出现为构建基因编辑细胞株提供了一个全新的视野。转座子也被称为跳跃基因,由Barbara McClintock教授在上世纪50年代发现,并于1983年因此发现而获得诺贝尔医学奖,是指一段DNA序列由基因组的一个位置跳跃到另一个位置。)制造的,旨在提高疗效的同时将毒性降至最低。研究中改进可生产工艺和给药方案的确带来了更好的安全性和更高的疗效。P-BCMA-101显著提高了疗效和安全性上,更加便利了MM的治疗,且便于门诊输注,在未来的临床应用上前景广阔。
上海交通大学医学院附属仁济医院血液科
国际骨髓瘤工作组(IMWG)委员
中华医学会血液学分会常委
中国抗癌协会血液肿瘤专委会常委
中国医师协会血液科分会常委
中国医师协会肿瘤科分会委员
CSCO中国抗淋巴瘤联盟常委
CSCO中国抗白血病联盟副主委
中国病理生理学会实验血液学分会委员
中国免疫学会血液免疫分会常委
上海医学会第10届血液学分会主委
上海免疫学会血液免疫专委会主委
中国医药创新促进会药物临床研究专委会副主委
?





 京公网安备 11010502033352号
京公网安备 11010502033352号