《肿瘤瞭望》:谈一谈骨髓纤维化症的治疗挑战?
Verstovsek教授:骨髓纤维化症(MF)在治疗上的挑战是多方面的,但通常而言,其治疗挑战主要可概括为以下三大问题:即贫血、脾脏不断肿大和生活质量下降。在MF新药研发时也主要针对于这些方面,旨在控制或改善以上症状,延长患者的生存期。芦可替尼(Ruxolitinib)是第一个获批并证实可有效治疗MF的药物,但芦可替尼并非适合所有MF患者,其疗效也并非永远持续存在。几乎所有MF患者在1~3年后表现为芦可替尼治疗失败,后续则需要转换为另外一种治疗,考虑到应持续改善MF患者的贫血、脾大和生活质量,故探索有效的二线治疗方案是当前MF患者的首要需求。我们期待研发出可治愈MF的药物,但目前仍难以实现这一目标,而改善以上三大方面的问题才是当前应重点关注的。
《肿瘤瞭望》:本次ASH设置了多项专题会议,能否请您介绍一下骨髓纤维化症的专题会议内容?
相关研究:#3006.Long-Term Safety of Fedratinib in Patients with Intermediate- or High-Risk Myelofibrosis (MF)
Fedratinib在中高危骨髓纤维化患者中的长期安全性
本研究纳入中度或高风险原发性、真性红细胞增多症后或原发性血小板增多症后MF患者。患者以30-800 mg/天的剂量范围连续接受fedratinib治疗,最长持续6个治疗周期(每个周期28天)。最大耐受剂量为680 mg/天。6个周期后疾病稳定、临床改善或完全或部分缓解(IWG-MRT反应标准)的患者可以在剂量探索研究中接受的末次fedratinib剂量水平进入TED12015扩展研究。在扩展研究期间,每3个周期进行一次研究中心访视,直至周期13,然后每6个周期进行一次。在此,我们报告了在TED12037和TED12015中接受 > 24个总治疗周期的患者接受fedratinib治疗的长期安全性,评估指标为治疗后出现的不良事件(TEAE)报告,总结周期36前每6个周期一次,以及36个周期后的总体结果。特别关注的后期出现的TEAEs为心脏、感染和神经系统事件。
共59例患者入组I期 的剂量探索研究;其中43例患者(73%)入组TED12015扩展研究,28例患者(47%)在两项研究中接受了 > 24个周期的fedratinib治疗,组成了长期(LT)队列。59例患者中的11例(19%)在第24周期前因TEAE停药。
在LT队列中,研究入组时的中位年龄为62.5岁(范围43-82岁)。患者接受fedratinib治疗的中位周期数为46周(范围:25-72)。每例患者的中位平均fedratinib剂量为462 mg/天(范围283-800),总体治疗依从率为98%(80%-100%)。LT队列中 > 1例患者停用fedratinib的原因为研究者决定(n = 10)、TEAEs(n = 5)、研究终止(n = 5)和疾病进展(n=4)。
在fedratinib治疗>24个周期后,最常见的TEAEs为血液学和胃肠道(GI)事件,其发生率低于或与早期治疗周期相似。第24周期后 > 1例患者报告的3-4级TEAEs为血小板减少、贫血、中性粒细胞减少和肺炎。很唯一关注的心脏事件为第7周期发生的1例充血性心力衰竭(1级)。第24周期后在 > 1例患者中观察到的唯一感染事件为肺炎;在4例患者报告的5起事件中,所有事件均为3级或4级,2起事件被认为可能与治疗相关。在任何时间报告3例3-4级严重神经系统事件:带状疱疹后神经痛(2例患者,周期10和周期36)和脑血管意外(1例患者,周期1)。
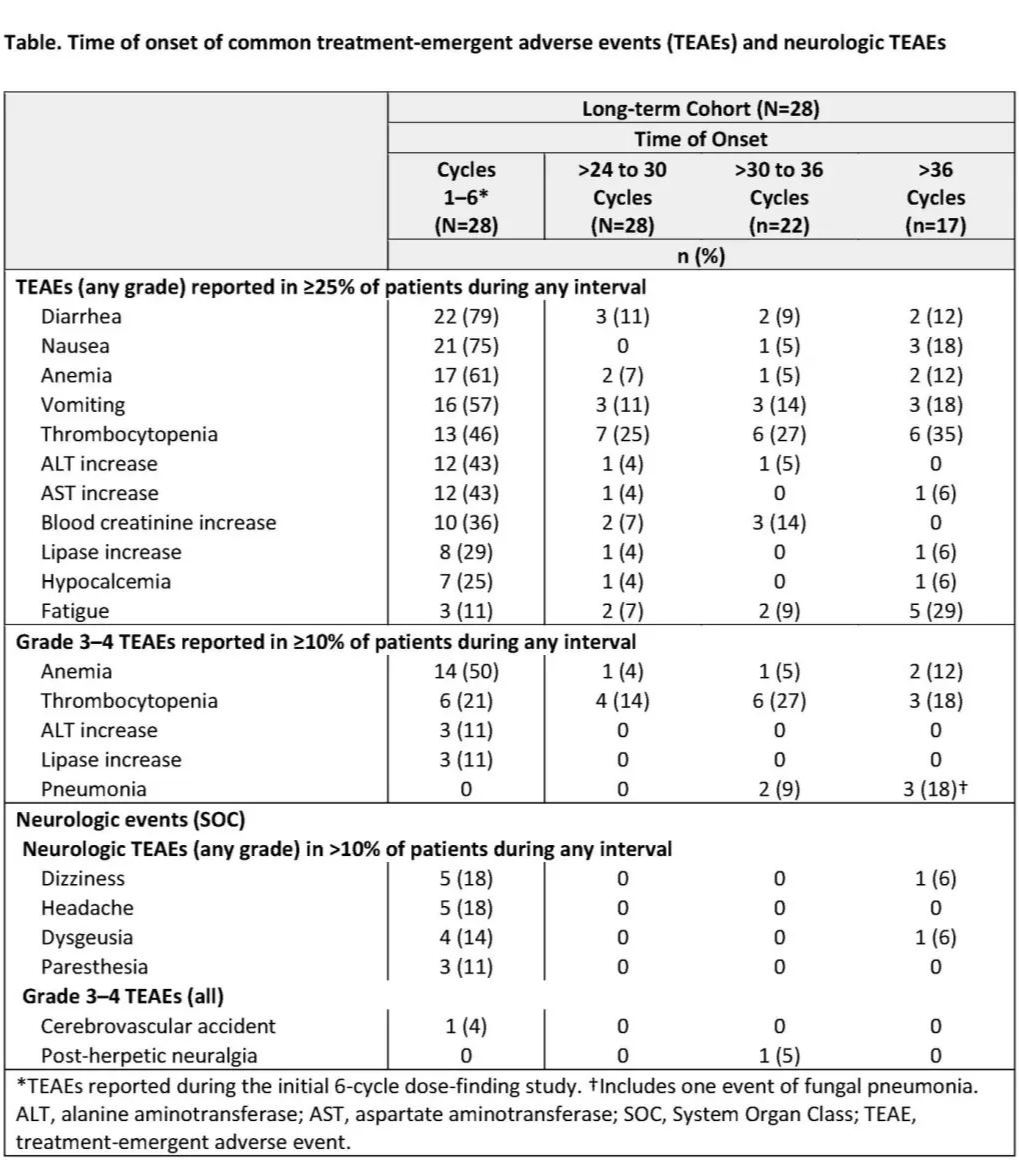
Fedratinib在持续治疗>24个周期的患者中仍耐受良好。在第1-6周期后,TEAEs的发生频率通常降低或保持稳定。
Verstovsek教授:由于骨髓纤维化症(MF)的主要问题为贫血、脾大及生活质量低下,因此治疗上可应用JAK抑制剂芦可替尼(Ruxolitinib)或菲卓替尼(fedratinib),此两种药物均已被批准用于控制MF患者的相关症状及脾大,但目前尚无任何药物可有效控制MF的贫血症状,我们希望上述两种药物的疗效能持续存在,可事实上并非如此,因此我们正在致力于研发新型二线药物,这也是当前MF治疗的首要任务。在这种背景下,MF领域涌现了诸多的进展,例如KRT-232、imetelstat或CPI-0610等药物可用于芦可替尼或菲卓替尼之后的二线治疗,并显示出一定的治疗作用,可以控制脾大、相关症状或贫血。此外,另外一种JAK抑制剂momelotinib单药用于MF二线治疗也显示出治疗活性,而联合应用多种JAK抑制剂也能提高治疗反应率、改善脾大和相关症状。在本次ASH大会上,我们报道了关于MF联合治疗的相关临床研究,将CPI-0610(BET抑制剂)与芦可替尼联合、Navitoclax(BCL-2抑制剂)与芦可替尼联合、luspatercept与JAK抑制剂联合,这很有可能进一步改善MF患者的脾大、症状及贫血,这也意味着联合治疗能为次优反应者带来改善贫血的获益。最后,还有一种改善MF患者预后的可能性,即在确诊时和需要治疗时就开始应用联合治疗(也就是说从治疗的第一天就应用联合方案)。在这种情况下,一开始便采用CPI-0610与芦可替尼联合治疗,这种方案极具吸引力,也是既往未尝试过的。基于目前结果,联合治疗的疗效似乎要优于芦可替尼单药治疗,但目前仍处于探索性阶段。值得指出的是,我上述提到的各种新型药物均应尽快开展III期临床试验,证实其是否能为MF患者带来显著获益,进而得到获批。
《肿瘤瞭望》:能否介绍一下Momelotinib在既往接受过或未经JAK抑制剂治疗的中高危骨髓纤维化症患者中的疗效结果和研究设计?
相关研究:#54.Robust Overall Survival and Sustained Efficacy Outcomes during Long Term Exposure to Momelotinib in JAK Inhibitor Naïve and Previously JAK Inhibitor Treated Intermediate/High Risk Myelofibrosis Patients
在JAK抑制剂初治和既往接受过JAK抑制剂治疗的中/高风险骨髓纤维化患者中继续Momelotinib期间总生存期和持续疗效的研究。
Momelotinib是一种强效JAK1、JAK2和ACVR1抑制剂,对骨髓纤维化(MF)的三个标志性特征(即贫血、全身症状和脾肿大)具有临床活性,在既往进行的iii期SIMPLIFY-1和-2临床试验(S1、S2)中证实的中/高风险MF患者(JAKi初治或既往JAKi治疗)的连续统一体中。在JAKi初治MF患者(n = 432)中进行S1,在24周双盲给药期间以1:1的比例随机接受MMB或芦可替尼(RUX)。在既往RUX治疗期间发生血液学毒性的MF患者(n = 156)中进行S2,在24周开放标签给药期间以2:1的比例随机接受MMB或最佳可用治疗(BAT;88%的患者包括RUX)。在两项试验中,在24周随机治疗(RT)期后,最初随机分配至MMB的患者可以继续MMB治疗(MMB→MMB),随机分配至RUX/BAT的患者有资格交叉至MMB(RUX/BAT→MMB)进行额外的扩展治疗(ET)。在该化合物的临床开发项目期间,超过820例MF患者接受了MMB治疗。
此处报告了S1和S2的长期结局数据,包括生存期、缓解终点和MMB暴露。随访总生存期(OS)和无白血病生存期(LFS)最长约5年(S1的中位数为2.9年,S2的中位数为2.3年)。在参加S1和S2后,患者有资格通过延长用药方案(XAP)继续接受MMB治疗,以及额外的ii期MMB受试者。暴露持续时间包括XAP数据,但OS/LFS分析仅包括S1和S2内获得的数据。
在入组XAP的137例ii期和iii期患者中,105例仍接受MMB治疗,治疗持续时间长达10年。
在S1的RT和ET期间以及XAP治疗期间,随机分配至MMB组的215例JAKi初治患者中69%的患者维持治疗≥48周;44%的患者维持治疗≥96周,30%的患者维持治疗≥144周。在S2中随机接受MMB的104例既往JAKi暴露受试者中,47%接受MMB(RT、ET和XAP)治疗≥48周;25%接受≥96周,17%接受≥144周。
在S1和S2中,治疗组之间的OS和LFS相似(S1中OS的分层HR为0.99,S2中为0.96),表明开始JAKi治疗的MMB患者和最初接受RUX/BAT治疗随后接受MMB的患者的生存结局稳健且一致(图1)。此外,S2组的中位OS(MMB组为34.3个月)与既往报告的RUX停药患者的中位生存期(13-30个月)相比非常有利(Tang,ASH 2019)。在S1中,MMB组26.5%的患者和RUX组29.5%的患者达到脾脏缓解,定义为第24周时脾脏体积较基线减少≥35%(非劣效性p<0.001)。在ET阶段,使用研究前脾脏大小作为基线,共观察到35例新的缓解,包括22例RUX→MMB受试者的缓解。总体而言,在S1中随机接受MMB的患者中,40%在研究期间的任何时间达到脾脏缓解。在S1和S2的ET期间均观察到稳健的脾脏反应持续时间。

目前这些数据表明,MMB具有持久解决中/高风险MF患者未满足需求的潜在能力。
Verstovsek教授:momelotinib是一类JAK抑制剂,它作为JAK1和JAK2抑制剂已经进行了很长时间的临床研究,近期已有III期研究对其进行报道和公布。SIMPLIFY-1研究在MF确诊的第一天或需要治疗时,分别比较了momelotinib和芦可替尼在MF一线治疗中的疗效,将MF患者随机分配至momelotinib组或芦可替尼组,旨在比较此两种药物对脾大症状的控制能力,结果显示这两种药物的脾大控制力基本相似,但在改善患者的生活质量方面,芦可替尼要优于momelotinib。SIMPLIFY-2是一项III期临床研究,主要针对于既往经JAK抑制剂芦可替尼治疗的MF二线治疗,将患者随机分配至最佳有效治疗组(BAT,包括续用芦可替尼)或momelotinib,结果显示,此两种治疗方案对于脾大的控制效果基本相同,但在生活质量和贫血症状的改善方面,momelotinib均要优于芦可替尼。但遗憾的是,该项研究的设计并非完美,因此momelotinib未能在美国及全球范围内获批。在接下来,我们将开展III期临床试验(MOMENTUM研究)来比较momelotinib与达那唑在MF二线治疗中的疗效,旨在比较其对于脾大、临床症状及贫血等方面的改善能力,我们期待momelotinib在不久的将来得到获批。
《肿瘤瞭望》:谈一谈 Momelotinib 与其它JAK抑制剂的区别?
Q4: Could you please explain the difference between the Momelotinib and other Jak inhibitor?
Verstovsek教授:与已经获批的芦可替尼一样,momelotinib也是一种JAK抑制剂,但同时两者也存在较为明显的差异,其差异主要与momelotinib可影响患者体内的铁代谢有关。该药物实际上可降低铁调素水平,当铁调素水平较高时,它能阻止体内铁的生成,从而影响造血。因此,momelotinib通过抑制ACVR1和铁调素能为MF患者带来额外的临床获益,这一点在之前的III期研究中得到了证实(既往的III期研究分别比较了momelotinib vs 芦可替尼在MF一线治疗、momelotinib vs BAT在MF二线治疗中的疗效),在这些研究中momelotinib对于MF患者的脾大、临床症状及贫血均有明显疗效。不同于其它JAK抑制剂,momelotinib非常值得进一步探索。事实上,MOMENTUM研究正在进行中,该研究旨在比较momelotinib与达那唑在MF二线治疗中对贫血的改善能力,若该研究获得成功,则momelotinib将会获批,从而使得我们在控制MF临床症状、贫血及脾大方面增加了一种新的治疗选择。最后,ASH大会上的一项研究表明momelotinib在提升MF患者生存方面要优于芦可替尼,因此我认为MOMENTUM研究之后,momelotinib将有很好的获批前景,尤其是在芦可替尼之后的MF二线治疗中。
MD Anderson血液肿瘤专家。
领导超60多项新型MPN药物的早期/晚期临床试验,包括2019年FDA批准的唯一用于骨髓纤维化(MF)的药物芦可替尼
已在主要医学期刊上发表了23篇重磅文章,以及超过550篇同行评审的原始文章/综述,例如新英格兰医学杂志、血液、白血病和柳叶刀。
获得多个奖项,包括Waun Ki Hong Faculty award for Excellence in Team Science(2020)、杰出临床学院指导奖(2021)、Otis&Pearl Walters Faculty Achievement award in Clinical Research(2017)、第七届年度Irwin H. Krakoff award for Excellence in Clinical Research(2013)、和Celgene青年研究者奖(2010)。
?





 京公网安备 11010502033352号
京公网安备 11010502033352号