研究背景:帕博利珠单抗被批准用于多种肿瘤,剂量为200mg或2mg/kg Q3W或400mg Q6W,静脉输注。KEYNOTE-555(NCT03665597)队列A是一项开放标签的I期研究,研究了2种不同浓度的帕博利珠单抗的皮下制剂(SC)与静脉输注(IV)的相对生物利用度。
研究目的:晚期黑色素瘤患者在前3个治疗周期中随机分配接受(交叉设计,见图1)1剂帕博利珠单抗 200mg IV和2剂帕博利珠单抗285mg SC(每种SC制剂各一种);此后,所有患者接受帕博利珠单抗 IV长达2年。本研究通过周期1、周期2和周期3收集31例患者的帕博利珠单抗血清浓度数据的贝叶斯分析和既往发表的帕博利珠单抗IV数据,用于阐述帕博利珠单抗 SC的药代动力学(PK)。分布和消除参数、时间依赖性清除率和来自于药物的协变量效应使用既往建立的帕博利珠单抗 IV的 PK模型。注射部位反应通过监测患者在前3个周期使用帕博利珠单抗 SC或IV后约1小时的局部皮肤反应,以及监测后使用患者问卷进行评估。

图1. 研究设计
研究结果:结果显示帕博利珠单抗SC的吸收具有一级吸收速率,但具有滞后时间和生物利用度参数。两种帕博利珠单抗SC制剂的PK与估计生物利用度为64%(95%CI:54~74)相似;这与其他SC单克隆抗体的生物利用度报告的50%至85%的生物利用度一致。SC配方对生物利用度、滞后时间或吸收率的协变量影响没有统计学意义,表明两种SC制剂在吸收阶段没有显著差异。3个疗程后均未见抗药性抗体。一般来说,在前3个周期内,帕博利珠单抗SC制剂耐受性良好,没有明显的注射部位反应。从SC和IV制剂中分别报告了两例2级瘙痒和皮疹不良事件。图2显示SC达到稳态的时间有滞后性,但最终的生物利用度与IV相似。
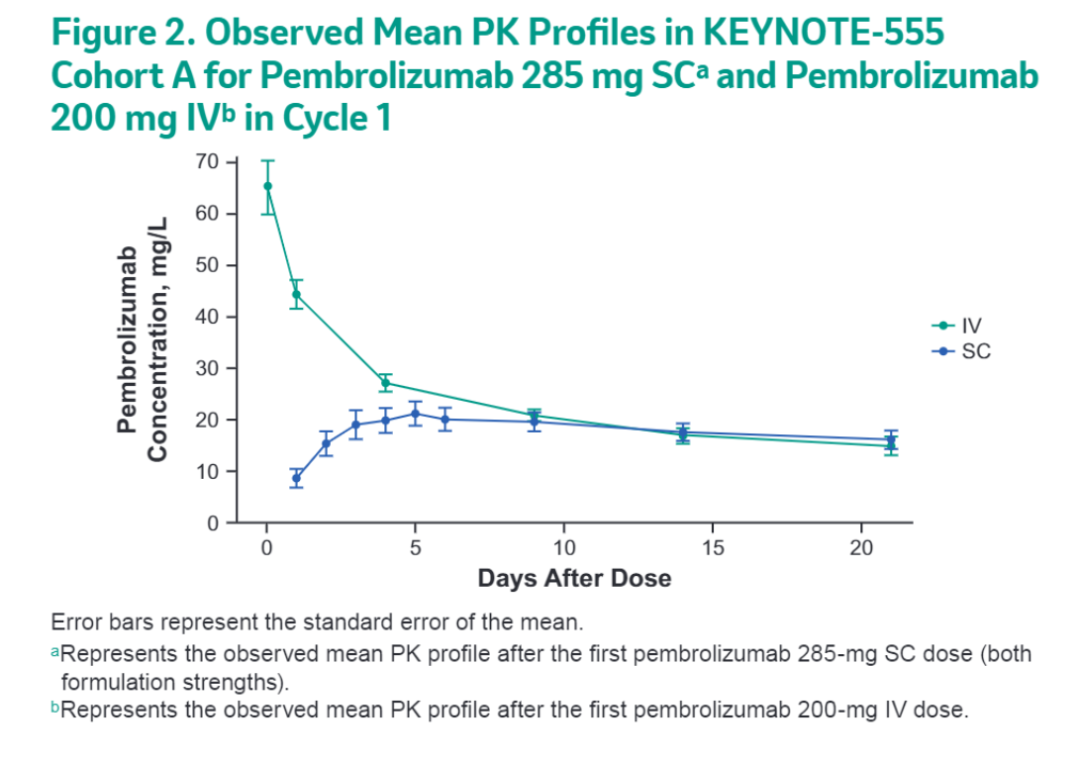
图2. 皮下和静脉注射第一个疗程的平均PK
研究结论:帕博利珠单抗皮下制剂的生物等效性在黑色素瘤中已初步证实,将在其他瘤种中进一步评估。
PD-1/L1单抗在实体瘤中的应用越来越广泛,在新冠疫情常态化的全球大环境下,如何方便有效的使用药物成为了临床关注的问题。国内外学者在使用方面进行了诸多改进:
1、延长时间给药
1)帕博利珠单抗:2020年AACR会议报道的KN555队列B的结果在去年的AACR已经公布(具体可查阅笔者去年:PD-1/L1单抗多久用一次)了帕博利珠单抗400mg/6周与200mg/3周一次的预期暴露量相似,暴露-反应关系支持每6周给药的临床疗效和安全性,鉴于此研究,我国NMPA已经将400mg/6周写入了帕博利珠单抗的说明书中。
2)纳武利尤单抗:该药物也经历了3mg/Kg每2周,240mg每2周方案和480mg每4周方案。纳武单抗的480mg每4周方案已经在欧洲和美国得到批准,其大样本跨瘤种研究发表在2020年2月的Annals of Oncology上。该研究的研究学方法与KN555研究基本相似,显示出这三个剂量组和不同治疗间隔在黑色素瘤、非小细胞肺癌、肾癌、膀胱癌、头颈部鳞癌、淋巴瘤等瘤种中的血液动力学、疗效和安全性数据上有较好的一致性。
3)阿替利珠单抗:2019年也报道了类似的临床研究,该研究荟萃了6个临床研究(包含I-III期非小细胞肺癌以及尿路上皮癌)的患者,对阿替利珠单抗840mg/2周方案,1200mg /3周方案和1680mg /4周方案在药物代动学、客观有效率、生存以及安全性等指标进行了比较,认为三种剂量模式具有一致的有效率以及安全性,临床支持其互换,以满足临床的不同需求。结果发表于2019年Cancer Chemother Pharmacol杂志,于2019年底获得FDA对其新版说明书的修订许可。
2、改变剂型
全球目前正在开发皮下剂型有两大类,一类是PD-1单抗(帕博利珠单抗、纳武利尤单抗、PF-06801591)的皮下注射剂型,还有一类是PD-L1单抗的皮下注射剂型(KN035和IMMH-010)。值得一提的是,我国自主研发的KN035已获得NMPA的优先审评,有望成为全球第一个上市的PD-L1单抗的皮下剂型。
1)PF-06801591
PF-06801591是由辉瑞开发的一款皮下注射PD-1单抗。2019年JAMA Oncology发表了PF-06801591皮下注射与静脉注射的I期对照研究结果。2016年3月8日至2018年3月5日,共入组了40例局部晚期或转移性实体瘤患者。每3周静脉注射0.5、1、3或10mg/kg PF-06801591,或每4周皮下注射300mg。结果表明,PF-06801591每4周1次皮下注射较每3周1次静脉注射在多种肿瘤类型中均显示出了抗肿瘤活性,并且耐受性良好,未发现严重的皮肤毒性作用。PF-06801591的每月1次皮下注射给药可以提高患者依从性,有望成为静脉注射的替代方案。
2)KN035
KN-035是由重组抗PD-L1人源化单域抗体与Fc区域组成的融合蛋白,最初由苏州康宁杰瑞生物科技开发,后由苏州康宁杰瑞生物科技和四川思路迪药业共同研发,目前由先声药业负责全国商业推广。2020年 ASCO年会上,公布了KN035单药在微卫星不稳定(MSI-H)肿瘤/错配修复功能缺陷(dMMR)晚期实体瘤的临床试验数据。中国25个中心招募103例MSI-H / dMMR晚期癌症患者。截止到2019年12月,总体人群经确认的客观缓解率为34.0%(95%CI:24.9%~44.0%),85.7%的缓解在数据截止时仍在持续。该药物于2020年11月16日递交了上市申请,适应症是针对MSI-H和dMMR患者的治疗。
药物使用方式的改变,可能大大提高给药的便捷性,改善患者生活质量,形成门诊式肿瘤诊治模式。在目前免疫检查点抑制剂为主导的肿瘤治疗大趋势下,优化药物使用方法,可能为肿瘤治疗带来新的变革,真正实现肿瘤患者的长期管理。





 京公网安备 11010502033352号
京公网安备 11010502033352号