基于影像学检查的实体瘤疗效评价仍存在一定的局限性,而组织活检也受到有创性、样本量不足等限制。近年来,众多研究开始探讨将液体活检作为肿瘤疗效评价和随访监测的补充手段,但其量化标准、临床验证尚不足。
2021年7月7日,Nature旗下的Signal Transduct Target Ther杂志在线发表了中国医学科学院肿瘤医院易宗毕、马飞(通讯作者)、荣国华、刘斌亮、王文娜、管秀雯、莫红楠、王佳妮、钱海利、徐兵河(通讯作者),北京吉因加基因研究院管彦芳以及北京市朝阳区桓兴肿瘤医院孙晓莹等学者合作完成的一项研究,首次通过前瞻性大样本临床研究探讨循环肿瘤DNA(ctDNA)分子肿瘤负荷指数(mTBI)作为肿瘤疗效和患者预后评价的生物学标志物。

随着众多新型抗肿瘤药物的研发问世,越来越多的晚期癌症患者生存期得到改善,实现长期带瘤生存。目前,基于影像学检查的肿瘤评价系统(如RECIST评价标准)仍是药物临床试验及患者随访中疗效评价和监测的主要手段。
然而,影像学检查的疗效评估和疾病监测仍存在诸多局限性,比如CT等常规放射性检查具有一定的辐射,且对骨转移病灶的评价有限;缺乏病理或生物标志物特征及信息;难以区分治疗过程中的肿瘤坏死组织;对免疫治疗假性进展的判断不够准确等。此外,影像学评价的肿瘤近期疗效不能很好地预示患者的远期生存获益,尤其是初始治疗评价为疾病稳定(SD)状态的患者,其远期疗效和生存情况尚不清楚。
因此,需要寻找新的肿瘤评价方法,以改善目前影像学评价的不足,或作为影像学疗效评价标准的补充,从而进一步完善实体瘤疗效评价体系。
在晚期癌症患者中,对远处转移病灶进行组织活检有助于治疗决策的制定,已被ASCO、NCCN、ESMO等国际指南推荐。但组织活检为有创操作,且活检样本量有限,难以完全反映肿瘤的异质性。
近年来,循环肿瘤DNA(ctDNA)等液体活检方法受到研究关注。作为一种新的肿瘤负荷量化方法,ctDNA相较于组织活检具有无创、不受组织样本限制、可反映肿瘤异质性等优点。相较于影像学评价,ctDNA无放射性暴露,且可以区分假性和真性进展,用于监测放射检查难以评价的病灶(如骨转移)。此外,ctDNA还可以提供驱动基因、耐药基因等生物学信息。
已有众多研究探讨将ctDNA作为新的肿瘤评价手段,但多数研究集中在特定基因,且缺乏量化ctDNA、量化肿瘤负荷的标准。2020年5月1日,徐兵河教授、马飞教授团队发表于《国际癌症杂志》(Int J Cancer)的研究表明,ctDNA的动态变化可以反映肿瘤负荷的变化,比影像学更早地监测到疾病进展。此外,该研究还初步确定,分子肿瘤负荷指数(mTBI,测量样本中ctDNA的百分比)相较于单基因突变更适合于肿瘤疗效评价。
ctDNA的临床应用仍面临诸多挑战,包括进一步明确其与抗肿瘤治疗的预后和/或疗效预测相关性,获得大样本患者队列的验证结果,证明其作为常规影像学检查以外的临床效用价值。
2021年7月7日,徐兵河教授、马飞教授团队及其合作团队发表于《信号转导与靶向治疗》(Signal Transduct Target Ther)的研究,首次通过前瞻性大样本临床研究,进一步验证了基于ctDNA的mTBI作为抗肿瘤治疗效果和预后生物学标志物的价值。
该研究利用Ⅲ期CAMELLIA研究的二次分析,收集了125例转移性乳腺癌患者的291份血浆样本,对1021个基因进行靶向捕获深度测序,并检测ctDNA的体系突变。
在117例患者治疗前样本中,中位mTBI为2.2(范围:0~36.0),治疗前的mTBI与肿瘤负荷呈显著相关(P=0.025),但与转移部位数(P=0.060)、内脏转移状态(P=0.209)无显著相关。
研究通过Bootstrap重采样法确定预测PFS和OS的最佳mTBI阈值分别为1.7和2.0。结果显示,与治疗前低mTBI(<2.0)患者相比,高mTBI(>2.0)患者的中位OS显著更短(下图b,40.9 vs 68.4个月,HR 2.03,95%CI:1.19~3.49,P=0.011)。但低mTBI(<1.7)和高mTBI(>1.7)患者的中位PFS无显著差异(下图a)。
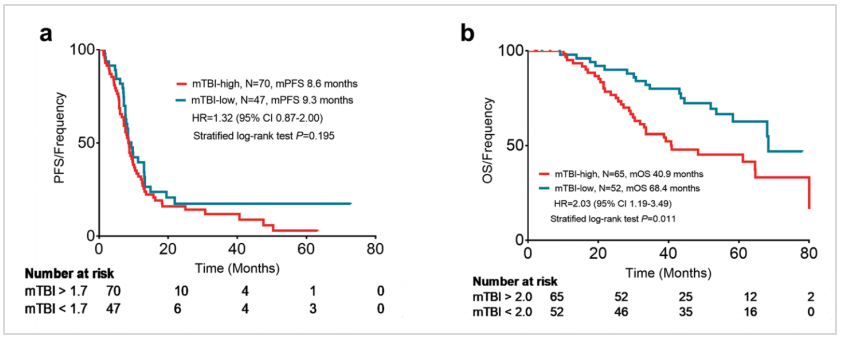
研究进一步分析了治疗早期(第一次肿瘤评估时)mTBI下降幅度与患者生存的关系。结果显示,mTBI 降低到0.02%以下的患者,中位PFS(下图c,10.9 vs 7.2个月,HR 1.91,95%CI:1.26~2.89,P<0.001)和中位OS均显著更长(下图d,68.1 vs 43.5个月,HR 2.21,95%CI:1.23~3.63,P=0.007)。

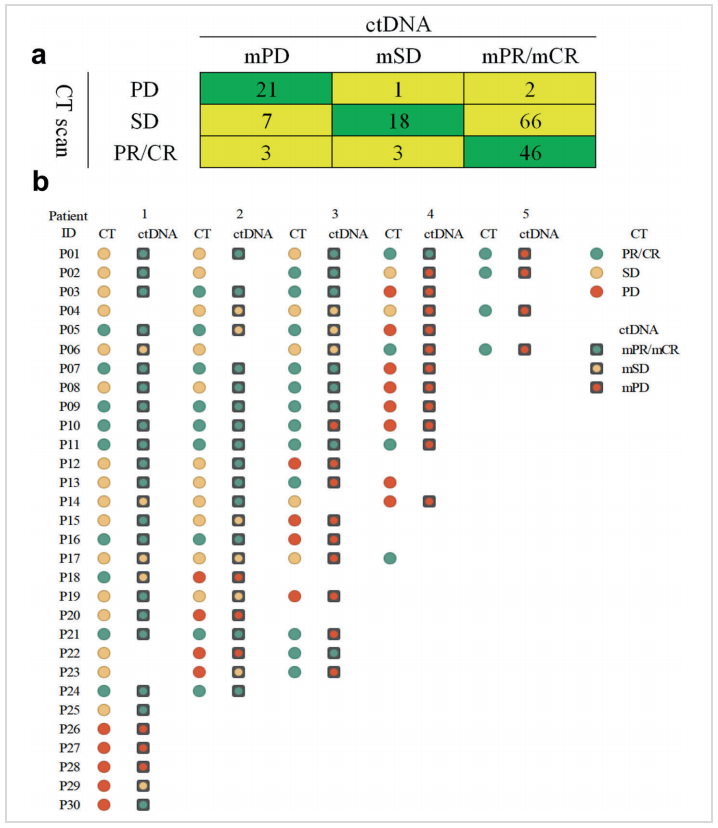
该研究分析了mTBI的受试者工作特征曲线(ROC)值为0.98(P=0.002),提示mTBI可以作为肿瘤疗效评估的有效工具。通过与CT检查(RECIST 1.1)对比发现,二者具有很好的一致性,mTBI与影像学评价的CR/PR一致性为88.5%(46/52,下图a),PD一致性为87.5%(21/24,下图a);而且有16.7%(5/30)的患者可以通过液体活检相较于CT检查更早发现PD(下图b)。
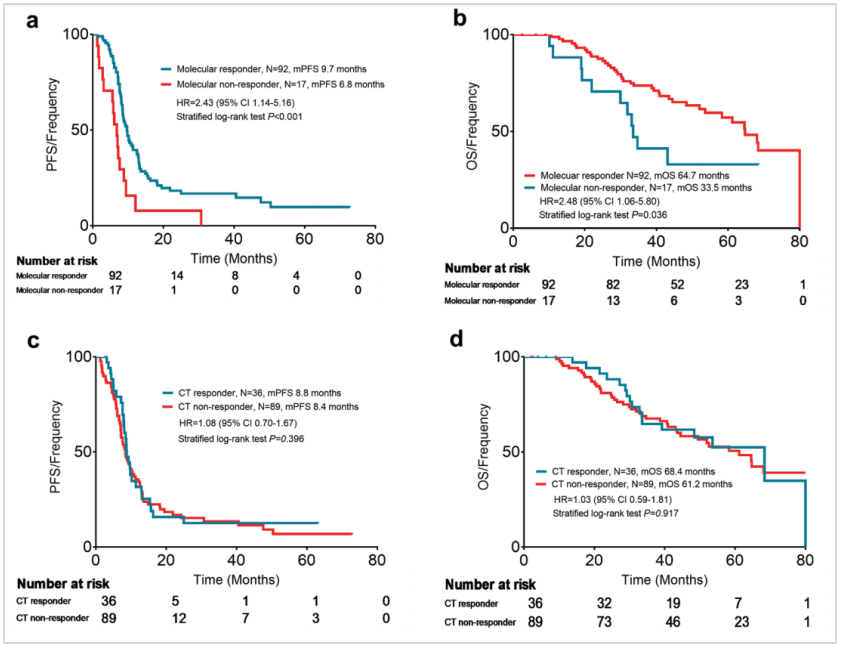
研究进一步分析了2个周期治疗后mTBI或CT疗效评价的生存结局。结果显示,mTBI评价达到分子学缓解的患者与未缓解的患者相比,中位PFS(下图a,9.7 vs 6.8个月,HR 2.43,95%CI:1.14~5.16,P<0.001)和中位OS均显著更长(下图b,64.7 vs 33.5个月,HR 2.48,95%CI:1.06~5.80,P=0.036);而CT评价达到缓解与未达到缓解患者的PFS和OS均无显著差异(下图c和d)。
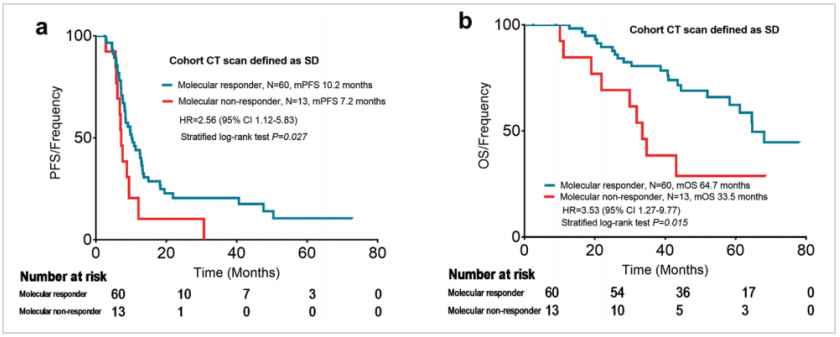
在73例由CT评价为SD的患者中,mTBI可以进一步识别出患者的预后差异,即mTBI评价为分子学缓解与未缓解的患者相比,中位PFS(10.2 vs 7.2个月,HR 2.56,95%CI:1.12~5.83,P=0.027)和中位OS显著更长(64.7 vs 33.5个月,HR 3.53,95%CI:1.27~9.77,P=0.015)。
总结:该研究首次通过大规模前瞻性临床试验样本证明,液体活检ctDNA分子肿瘤负荷指数可以很好地预测转移性乳腺癌患者治疗效果和长期生存结局,提示其可以作为RECIST评价标准的补充,辅助临床决策。期待未来能有来更多的前瞻性大样本多瘤种的临床研究来验证此结论,促进该全新的肿瘤疗效评价方法向临床转化。
[1]Yi Z, Ma F, Rong G, et al. The molecular tumor burden index as a response evaluation criterion in breast cancer. Signal Transduct Target Ther. 2021;6(1):251. Published 2021 Jul 7. doi:10.1038/s41392-021-00662-9[2]Ma F, Guan Y, Yi Z, et al. Assessing tumor heterogeneity using ctDNA to predict and monitor therapeutic response in metastatic breast cancer [published correction appears in Int J Cancer. 2020 Jun 15;146(12):E8]. Int J Cancer. 2020;146(5):1359-1368. doi:10.1002/ijc.32536





 京公网安备 11010502033352号
京公网安备 11010502033352号